14. Antikoagulationsbehandling
Dette kapitel omhandler behandling med antikoagulantia (AK-behandling), som beskrives i separate afsnit om non-vitamin K-antagonist orale antikoagulantia (NOAK), vitamin K-antagonister (VKA) og lavmolekylære hepariner (LMH).
14.1 Indikationer for AK-behandling
Tabel 14.1: Indikationer for AK-behandling og mulige behandlingsvalg | |||
Indikation | NOAK | VKA | LMH |
|---|---|---|---|
Atrieflimren/-flagren | + 1. valg | + | +* |
Venøs tromboemboli | + 1. valg | + | + |
Cancer-associeret trombose (se Kapitel 12: Lungeemboli og dyb venetrombose, Afsnit 12.4) | +** | ÷ | + |
Kronisk tromboembolisk pulmonal hypertension (CTEPH) | (+) Begrænset erfaring | + | + |
Intrakavitære tromber | + | + | + |
Mekaniske hjerteklapper | ÷ | + | + |
Moderat eller svær mitralstenose | ÷ | + | + |
Antifosfolipid syndrom, især hvis triple positiv | ÷ | + | + |
Tromboseprofylakse | (+***) | ÷ | + |
Trombose i portalvene-gebetet | (+)**** | + | + |
Grøn: Kan anvendes. Gul: Kan anvendes under visse omstændigheder. Rød: Frarådes. *LMH er aldrig undersøgt ved atrieflimren som langtidsforebyggelse af apopleksi og bør derfor kun anvendes, når behandling med andre antikoagulantia ikke er mulig **NOAK anses som førstevalg under hensynstagen til cancertype, antineoplastisk behandling og patientkarakteristika herunder blødningsrisiko, (se Kapitel 12: Lungeemboli og dyb venetrombose, afsnit 12.4) ***NOAK er i Danmark kun godkendt som tromboseprofylakse ved elektiv total hofte- eller knæalloplastik. Kapitlets forfattere og referenter finder det acceptabelt at anvende NOAK (fx rivaroxaban 10 eller 20 mg x 1 dagligt) til patienter med tidligere VTE med behov for kortvarig tromboseprofylakse udenfor hospitalsregi, fx i forbindelse med længere flyrejse. ****NOAK kan anvendes på lige fod med VKA og LMH hos patienter uden levercirrose eller patienter med kompenseret levercirrose (Child Pugh A). Splanknisk trombose omtales ikke yderligere i dette kapitel. Der henvises til retningslinjen ”Splanknisk trombose, diagnostisk og behandling” udgående fra Dansk Selskab for Gastroenterologi og Hepatologi. | |||
14.2 Kontraindikationer for AK-behandling
For præparatspecifikke kontraindikationer henvises til www.pro.medicin.dk. Dog bør nævnes, at NOAK-behandling er kontraindiceret hos patienter med mekaniske hjerteklapper, moderat/svær mitralstenose, triple positiv antifosfolipidsyndrom og svært nedsat nyrefunktion (kreatinin clearance <30 ml/min for dabigatran, kreatinin clearance <15 ml/min for rivaroxaban, apixaban og edoxaban).
Alvorlig eller livstruende aktiv blødning kontraindicerer AK-behandling. Aktiv blødning under AK-behandling kan kræve pausering og eventuelt reversering af AK-behandlingen, indtil der er opnået blødningskontrol (se Afsnit 14.7 Blødning under AK-behandling). Herefter kan AK-behandlingen hos de fleste patienter genoptages (se Afsnit 14.7.4 Genoptagelse af AK-behandling efter blødning).
Tidligere alvorlig/livstruende AK-associeret blødning kontraindicerer sjældent AK-behandling, men kræver særlig opmærksomhed, herunder håndtering af risikofaktorer for blødning, se Afsnit 14.7.4 Genoptagelse af AK-behandling efter blødning. Aurikellukning kan overvejes hos udvalgte patienter med atrieflimren/atrieflagren med stærk kontraindikation for AK-behandling under hensyntagen til komplikationsrate samt om patienten forventes at kunne tolerere efterbehandling med trombocythæmmer .
Leversvigt er en relativ kontraindikation for AK-behandling og kræver involvering af specialister. Det samme gælder svær trombocytopeni (se Tabel 14.8) og koagulationsforstyrrelser medførende betydeligt øget blødningstendens.
14.3 Varighed af AK-behandling
Behandlingsvarigheden afhænger af indikationen for AK-behandling. Ved atrieflimren/atrieflagren er behandlingen som udgangspunkt livslang (se Kapitel 15: Atrieflimren og atrieflagren). En undtagelse er patienter med lav CHA2DS2-VASc-score, der blot antikoaguleres kortvarigt, f.eks. i forbindelse med DC-konvertering (se Kapitel 16: Kardiovertering af atrieflimren/-atrieflagren). I disse situationer skal man være opmærksom på, at patienten formentlig på sigt får indikation for livslang AK-behandling.
Ved venøs tromboemboli (VTE), inklusiv cancer-associeret trombose, spænder behandlingsvarigheden fra 3-6 måneder til livslang. Behandlingsvarigheden individualiseres på baggrund af risikofaktorer (temporære og permanente), alvorlighed af VTE-eventet og patientrelaterede faktorer, herunder blødningsrisiko (se Kapitel 12: Lungeemboli og dyb venetrombose).
Mekaniske hjerteklapper indicerer livslang AK-behandling med VKA. Mitralklapssubstitution med biologisk klap samt mitralplastik indicerer 3 måneders AK-behandling, alternativt acetylsalicylsyre (se Kapitel 6: Hjerteklapsygdom).
Ved intrakavitære tromber gives minimum 3 måneders AK-behandling (se Kapitel 25: Kardiel embolikilde, Afsnit 25.5.2).
14.4 Peroral AK-behandling
14.4.1 Overvejelser i forbindelse med valg af peroral AK-behandling
Ved både atrieflimren og VTE bør NOAK foretrækkes frem for VKA, såfremt der ikke er kontraindikationer, fordi NOAK er en mere praktisk behandling og reducerer risikoen for alvorlige (særligt intrakranielle) blødninger sammenlignet med VKA. Visse patientkarakteristika (svært nedsat nyrefunktion, nedsat leverfunktion samt ekstrem overvægt) og patientpræferencer (lægemiddelpris) kan dog tale for VKA frem for NOAK.
De enkelte NOAKs er ikke sammenlignet direkte med hinanden i randomiserede kliniske undersøgelser. I forhold til valget mellem de enkelte NOAK-præparater kan følgende parametre overvejes:
- graden af renal udskillelse (dabigatran > rivaroxaban = edoxaban > apixaban)
- en- eller togangsdosering
- evidensniveau for de enkelte NOAK-præparater i forhold til patientens karakteristika (f.eks. alder, vægt, nyrefunktion, komorbiditet)
- bivirkningsprofil, herunder risikoen for gastrointestinal og urogenital blødning
14.4.2 Peroral AK-behandling med NOAK
Der er aktuelt 4 forskellige NOAK til rådighed: dabigatran (direkte trombinhæmmer), og rivaroxaban, apixaban og edoxaban (direkte faktor Xa-hæmmere).
Farmakologi
| Warfarin | Dabigatran | Rivaroxaban | Apixaban | Edoxaban |
|---|---|---|---|---|---|
Tid til max effekt | 3-5 dage | 2 timer | 2-4 timer | 1-4 timer | 1-2 timer |
Halveringstid | 20-60 timer | 12-17 timer | 5-13 timer | 8-15 timer | 10-14 timer |
Elimination | 100% galde | 80% renal | 35% renal | 30% renal | 50% renal |
Monitorering | INR | Nej | Nej | Nej | Nej |
Antidot* | Ja | Ja | (Ja) | (Ja) | (Ja) |
Dosering | 1 x dgl | 2 x dgl | 1 x dgl | 2 x dgl | 1 x dgl |
*Den direkte antidot til Faktor Xa-hæmmerne Andexanet alfa er ikke klinisk tilgængelig i Danmark. Ved behov for akut reversering kan i stedet anvendes protrombin kompleks koncentrat (Octaplex®) 25 IE/kg | |||||
Dosering
Doseringen af NOAK afhænger af behandlingsindikationen og patientkarakteristika, særligt nyrefunktionen, se Tabel 14.3.
Indikation | Dabigatran | Rivaroxaban | Apixaban | Edoxaban |
|---|---|---|---|---|
Forebyggelse af apopleksi og systemisk emboli hos voksne med non-valvulær AF | 150 mg x 2 dagligt eller 110 mg x 2 dagligt* | 20 mg x 1 dagligt eller 15 mg x 1 dagligt** | 5 mg x 2 dagligt eller 2,5 mg x 2 dagligt*** | 60 mg x 1 dagligt eller 30 mg x 1 dagligt**** |
DC-konvertering af non-valvulær AF >48 timers varighed | 150 mg x 2 dagligt eller 110 mg x 2 dagligt* | 20 mg x 1 dagligt eller 15 mg x 1 dagligt** | 5 mg x 2 dagligt eller 2,5 mg x 2 dagligt*** | 60 mg x 1 dagligt eller 30 mg x 1 dagligt**** |
Behandling og forebyggelse af dyb venetrombose og lungeemboli | 150 mg x 2 dagligt eller 110 mg x 2 dagligt* Forudgås af LMH i 5 dage | Initialt 15 mg x 2 dagligt i 3 uger, herefter 20 mg x 1 dagligt (evt. 15 mg x 1 dagligt ved GFR < 50 ml/min) Forebyggelse af recidiv: 10 mg x 1 dagligt***** | Initialt 10 mg x 2 dagligt i 7 dage, herefter 5 mg x 2 dagligt (dog 2,5 mg x 2 ved GFR <30 ml/min) Forebyggelse af recidiv: 2,5 mg x 2 dagligt***** | 60 mg x 1 dagligt eller 30 mg x 1 dagligt**** Forudgås af LMH i 5 dage |
Koronararteriesygdom eller symptomatisk perifer arteriesygdom og høj risiko for iskæmiske hændelser (Se Kapitel 3: Kronisk koronar syndrom og Kapitel 33: Perifer arteriesygdom) | Ikke godkendt til indikationen | 2,5 mg x 2 dagligt i kombination med ASA 75 mg x 1 dagligt | Ikke godkendt til indikationen | Ikke godkendt til indikationen |
AF = atrieflimren/atrieflagren, ASA=acetylsalicylsyre *Alder ≥80 år eller samtidig behandling med verapamil. Ved AF kan dosisreduktion ligeledes overvejes ved høj blødningsrisiko (og lav tromboembolirisiko), eller eGFR 30-50 ml/min. **GFR 15-49 ml/min ***GFR 15-29 ml/min eller 2 af følgende kriterier opfyldt: Alder ≥80 år, legemsvægt ≤60 kg, kreatinin >133 µmol/l ****1 af følgende kriterier opfyldt: GFR 15-50 ml/min, legemsvægt ≤60 kg, samtidig behandling med P-gp-hæmmere som ciclosporin, dronedaron, erythromycin eller ketoconazol *****Dosisreduktion undlades, hvis recidivrisikoen vurderes høj, f.eks. pga. betydende trombofili eller aktiv cancer, samt ved tidligere recidiv under behandling med reduceret dosis. | ||||
Dosering af DOAK ved trombe i venstre ventrikel: som udgangspunkt doseres som ved atrieflimren. Hos udvalgte patienter kan dosering som ved VTE (dvs. indledning med høj dosis) overvejes under nøje hensyntagen til blødningsrisikoen.
Kontrol og monitorering af NOAK-behandling
Der er ikke behov for rutinemæssig biokemisk monitorering af den antikoagulerende effekt af NOAK-behandling. INR har ingen værdi i monitoreringen. Plasmakoncentrationen af NOAK kan måles på de fleste laboratorier og kan primært anvendes til at afgøre, om der er NOAK til stede i blodet eller ej (f.eks. i forgiftningssituationer). Plasmakoncentrationsmåling hos f.eks. under-/overvægtige eller ved mistanke om interaktioner kan overvejes men anbefales ikke rutinemæssigt pga. manglende erfaring. Dosisjustering baseret på plasmakoncentrationsmålinger frarådes.
Ved påbegyndelse af NOAK-behandling tages følgende biokemiske analyser: hæmoglobin, væsketal med eGFR, trombocytter og levertal. Under NOAK-behandling skal nyrefunktionen kontrolleres efter 3 måneder og herefter efter individuel vurdering afhængig af bl.a. nyrefunktion, komorbiditet og øvrig medicinering, dog mindst 1 gang årligt. Nyrefunktionen bør desuden vurderes ved mistanke om fald heri, f.eks. ved sygdom, der medfører risiko for dehydrering.
Cirka én gang årligt revurderes indikation og kontraindikationer for AK-behandlingen, herunder eventuelle trombose/blødningskomplikationer. Dette bør inkludere gennemgang af medicinlisten med fokus på blødningsrisiko (f.eks. prednisolon, NSAID m.v.). Vigtigheden af komplians understreges. Blodtryk kontrolleres, og behov for eller justering af antihypertensiv behandling vurderes.
Interaktioner
Der er færre farmakokinetiske interaktioner for NOAK sammenlignet med VKA. De vigtigste er beskrevet i Kapitel 35: Farmaka og kardiovaskulære komplikationer, Tabel 35.2.
Farmakodynamiske interaktioner med lægemidler med antitrombotisk virkning (f.eks. trombocytfunktionshæmmere, NSAID og visse antidepressiva) medførerende øget blødningsrisiko under NOAK-behandling er hyppige og kræver særlig opmærksomhed. For anbefalinger vedrørende kombinationsbehandling med NOAK og trombocytfunktionshæmmere se Kapitel 1: Akut koronart syndrom, Afsnit 1.6.7 og Kapitel 3: Kronisk koronart syndrom, Afsnit 3.6.1.
Fødeindtagelse øger absorptionen af rivaroxaban i standarddoser (dvs. 15 mg og 20 mg) fra 66% til 90%. Tabletterne skal derfor indtages sammen med mad.
14.4.3 Peroral AK-behandling med VKA
Terapeutisk INR-niveau
Behandlingsintensiteten måles som protrombintid og udtrykkes som INR (International Normalized Ratio). Det terapeutiske interval for INR-niveauet er 2,0-3,0, dog 2,5-3,5 ved mekanisk mitralklap. Kvaliteten af VKA-behandling vurderes på baggrund af tid i terapeutisk interval (TTI). TTI ≥70% vurderes generelt som acceptabelt, omend der tilstræbes så høj TTI som muligt. Ved langvarig VKA-behandling fører selvstyret terapi til højere TTI end behandlerstyret terapi og bør altid overvejes hos patienter med indikation for livslang VKA-behandling.
Farmakologiske aspekter
I Danmark er warfarin og phenprocoumon de to indregistrerede præparater til VKA-behandling. Warfarin foretrækkes generelt pga. bedre dokumentation og kortere halveringstid. Den kortere halveringstid (36 timer versus 168 timer) er en fordel ved indledning af behandling, behandlingspause, blødningskomplikationer og ved interaktion med andre lægemidler. Ved amning anvendes warfarin, alternativt LMH.
Indledning af VKA-behandling
Før behandlingsstart:
- vurdér tilstedeværelse af kontraindikationer
- mål hæmoglobin, trombocytter, INR, kreatinin og levertal
- informér patienten grundigt (herunder vigtigheden af høj komplians), tilrettelæg behandlingskontrol, udlevér patientkort og opret INR-skema
- ved aktuel tromboembolisk sygdom uanset type samt med mekanisk hjerteklap indledes behandlingen altid under dække af heparin, oftest LMH i terapeutisk dosis
Behandlingen indledes med:
- warfarin: Formodet vedligeholdelsesdosis, typisk 5 mg/dag, dog lavere for ældre patienter
- phenprocoumon: Formodet vedligeholdelsesdosis, typisk 3 mg/dag, dog lavere for ældre patienter
Efter behandlingsstart måles INR på dag 5, dvs. efter 4 doser. Dette kan dog afviges, f.eks. afhængigt af patientens alder, øvrig medicinering og komorbiditet. Næste kontrol samt valg af videre dosering afhænger af det målte INR-niveau jf. Institut for Rationel Farmakoterapi: ”Start af warfarinbehandling”.
Vedligeholdelsesbehandling
God og sikker VKA-behandling forudsætter omhyggelig behandlingskontrol, som omfatter:
- vurdering af om TTI er acceptabel
- årlig klinisk patientkontrol, inkl. vurdering af behandlingsindikation, komplians, blodtryk, risikofaktorer, polyfarmaci med interaktionsrisiko, bivirkninger og komplikationer
Hyppighed af INR-målinger:
Generelt bør INR kontrolleres tæt ved indledning af behandlingen, indtil man har fundet den korrekte vedligeholdelsesdosis. Herefter kan intervallet mellem INR-målinger øges langsomt. Ved stabil langtidsbehandling kan intervallet mellem INR-målinger øges til maksimalt 4 uger.
Dosisændring:
Der er biologisk variation på serielle INR-værdier fra patienter i steady-state VKA-behandling. Derfor kan der være ret store ændringer mellem to på hinanden følgende INR-værdier, og er ændringen <30% (i praksis mindre end 0,5 i INR-værdi), kan dosisændringer udelades, og resultatet af en ny INR-værdi efter ca. 1 uge afventes. Hyppige dosisændringer øger risikoen for, at INR bringes uden for terapeutisk interval. Man kan acceptere enkeltstående INR-værdier over terapeutisk interval op til 4,5.
Kontrol af behandling:
Det er vigtigt, at kvaliteten af VKA-behandlingen vurderes og dokumenteres løbende. Hvis TTI vedvarende ligger <70 %, bør der søges forklaring herpå (se f.eks. www.pro.medicin.dk - Vitamin K-antagonister), og skift til NOAK bør overvejes ved fravær af kontraindikationer.
INR uden for terapeutisk niveau
Større afvigelser i INR skal altid undersøges (lægemiddelinteraktion, feber, kostomlægning, fejldosering, alkohol, etc.) og evt. konfereres med trombosecenter/AK-klinik. Blødning under AK-behandling behandles i Afsnit 14.7 Blødning under AK-behandling.
Ved subterapeutisk INR:
Hos patienter med mekaniske klapper og patienter med nylig tromboemboli, som under VKA-behandling får målt INR <1,8, anbefales tillæg af LMH i terapeutisk dosis, indtil INR igen er i niveau. For mekaniske mitralklapper bør LMH dog påbegyndes allerede ved INR <2,5.
Høj INR uden blødning:
4,5< INR <10:
- pausér behandlingen
- reversering med phytomenadion anbefales ikke rutinemæssigt
- daglig INR-måling indtil INR er i niveau, hvorefter behandlingen genoptages
INR >10 (eller over målbar grænse):
- overvej indlæggelse
- delvis reversering med phytomenadion 2,5-5 mg p.o. eller i.v. anbefales
Interaktioner
Et stort antal lægemidler, naturpræparater og kosttilskud øger eller hæmmer virkningen af VKA (se evt. www.pro.medicin.dk, www.interaktionsdatabasen.dk og www.drugs.com).
Fra starttidspunktet af en ny behandling, der interagerer med VKA, til fuld effekt af interaktionen ses en tidsforskydning, som er afhængig af halveringstiden for de vitamin K-afhængige koagulationsfaktorer. For warfarin ses fuld effekt af interaktionen efter ca. en uge og for phenprocoumon efter 3-4 uger. Effekten af interaktionen kan ligeledes vare ved, efter at behandlingen med det interagerende lægemiddel er ophørt. Hyppige INR-kontroller anbefales ved såvel påbegyndelse og ophør af potentielt interagerende medicin. Se Kapitel 35: Farmaka og kardiovaskulære komplikationer, Afsnit 35.5.3.
14.5 Parenteral antikoagulationsbehandling med hepariner, pentasakkarider og direkte trombinhæmmere
Heparinerne omfatter ufraktioneret heparin (UFH) og LMH, hvoraf kun LMH omtales nedenfor. Fondaparinux er det eneste tilgængelige parenterale pentasakkarid og anvendes i Danmark primært ved NSTEMI/UAP (se Kapitel 1: Akut koronart syndrom). Parenterale direkte trombinhæmmere (f.eks. bivalirudin og argatroban) anvendes kun på særlige indikationer og omtales ikke yderligere.
Lavmolekylære hepariner
Lavmolekylære hepariner fremstilles af UFH og adskiller sig bl.a. fra UFH ved deres lavere molekylevægt, længere halveringstid, mindre interaktion med trombocytter (lavere risiko for heparininduceret trombocytopeni) og relativt kraftigere hæmning af faktor Xa end trombin. I Danmark anvendes LMH-præparaterne dalteparin, tinzaparin og enoxaparin, som har sammenlignelige farmakokinetiske egenskaber (renal udskillelse, maksimal plasma koncentration 4-6 timer, halveringstid 2-4 timer). På trods af, at de tre LMH-præparater anvendes som fuldt substituerbare i klinisk praksis, varierer evidensen mellem de enkelte præparater ift. effektivitet og sikkerhed ved specifikke tilstande.
Dosering
LMH doseres efter præparat og indikation. Ved tromboseprofylakse gives LMH i fast dosis uden hensyntagen til vægt. Typiske daglige profylaksedoser er dalteparin 5000 IE, enoxaparin 40 mg eller tinxaparin 4500 IE. En undtagelse er tromboseprofylakse under graviditet, hvor LMH doseres efter kvindens prægravide vægt jf. DSTHs rapport og ledsagende app om ”Tromboembolisk sygdom under graviditet og post-partum”.
Ved brug af terapeutiske doser (typisk ved VTE, atrieflimren/atrieflagren eller mekaniske hjerteklapper) doseres efter vægt og under hensyntagen til nyrefunktionen som anført i Tabel 14.4. Dosis af dalteparin (men ikke enoxaparin og tinzaparin) reduceres med 25% (fra 200 IE/kg til 150 IE/kg) efter 1 måneds behandling hos patienter med VTE og cancer.
Den maksimale døgndosis for dalteparin er 18000 IE ved VTE og 10000 IE x 2 ved AKS uanset vægt, hvorfor enoxaparin eller tinzaparin er førstevalg ved vægt >120 kg, men bør overvejes frem for dalteparin allerede ved vægt >100 kg.
| Daglig dosis ved GFR >30 ml/min | Daglig dosis ved GFR ≤30 ml/min |
|---|---|---|
Dalteparin | 200 IE/kg s.c. x 1 (maksimalt 18000 IE/døgn) | GFR >20 ml/min: Uændret dosis |
Enoxaparin | 150 IE/kg s.c. x 1* | GFR 15-30 ml/min: Dosis halveres |
Tinzaparin | 175 IE/kg s.c. x 1 | GFR >30 ml/min: Uændret dosis |
*Ved indledning af behandlingen kan der gives 100 IE/kg x 2 dgl., særligt ved høj tromboserisiko | ||
Kontrol
Der er ikke behov for rutinemæssig biokemisk monitorering af den antikoagulerende effekt af LMH, da rutinemæssig monitorering ikke mindsker risikoen for blødning eller trombose. Ved behandlingssvigt samt ved betydelig risiko for akkumulering af LMH hos patienter med svær overvægt eller svær nyreinsufficiens kan man, især ved samtidig blødning, overveje monitorering med anti-faktor Xa i samråd med det lokale laboratorium.
Bivirkninger
Der henvises til www.pro.medicin.dk.
Af særlig interesse omtales her heparininduceret trombocytopeni (HIT). HIT type 1 indtræder timer efter indgift af LMH, og der er vanligvis tale om beskeden forbigående trombocytopeni. HIT type 2 indtræder oftest efter flere dages behandling og skyldes en immunmedieret reaktion, som optræder hos op til 5% af patienter behandlet med UFH og 0,1% af patienter behandlet med LMH. HIT type 2 medfører en høj risiko for trombose (både arteriel og venøs)og heraf amputation og død. Ved mistanke om HIT screenes med 4Ts scoren. HIT bekræftes eller udelukkes ved laboratorieundersøgelser. Ved betydelig mistanke om HIT (4Ts score ≥4) skal heparin straks seponeres og erstattes af anden AK-behandling (typisk argotraban eller fondaparinux, evt. bivalirudin eller NOAK). Udredning og behandling skal konfereres med trombosecenter/koagulationsvagt.
14.6 Skift mellem AK-præparater
Skift fra VKA til NOAK: INR måles ved behandlingsophør af VKA. Ved INR <2 kan NOAK påbegyndes med det samme. Ved INR 2,0-2,5 kan NOAK påbegyndes næste dag. Ved INR >2,5 afventes INR fald inden påbegyndelse af NOAK; INR kontrolleres efter 2-3 dage.
Skift fra NOAK til VKA: Ved påbegyndelse af VKA hos en patient behandlet med NOAK fortsættes NOAK, indtil INR er i terapeutisk niveau.
Skift fra NOAK til NOAK: Påbegynd det nye NOAK ved næste planlagte dosis af det tidligere anvendte NOAK.
Skift fra LMH til NOAK: Påbegynd NOAK 0-2 timer før næste planlagte subkutane dosis.
Skift fra LMH til VKA: Ved påbegyndelse af VKA hos en patient i LMH-behandling fortsættes LMH, indtil INR er i terapeutisk niveau i to på hinanden følgende målinger. Hos patienter med høj blødningsrisiko og fravær af manifest trombose eller høj tromboserisiko kan perioden med behandlingsoverlap reduceres eller undværes.
14.7 Blødning under AK-behandling
Ved blødning under AK-behandling anbefales, at man inddrager den regionale koagulations/blødningsvagt.
Ved mindre blødning vil pausering af behandlingen samt evt. kombineret med kompression være tilstrækkeligt.
Alvorlig og livstruende blødning behandles symptomatisk med blodprodukter (erytrocytter, frisk frosset plasma, trombocytkoncentrat), væske, tranexamsyre/lokal hæmostatika. Hvis muligt foretages kirurgisk kontrol af blødningen. Hæmostasen monitoreres initielt og kontinuerligt (standard hæmostasescreening: trombocytter, hæmoglobin, APTT, protrombintid, fibrinogen samt ved alvorlig livstruende blødning TEG/ROTEM) i tæt samråd med blødningsvagt. Se desuden ”Vejledning om transfusionsmedicinsk behandling og monitorering af den blødende patient” udgående fra Dansk Selskab for Klinisk Immunologi samt DSTHs blødningsapplikation. Herudover overvejes specifikke tiltag rettet mod ophævelse af effekten af pågående AK-behandling, tilpasset det specifikke præparat, som beskrevet i nedenstående.
14.7.1 Specifikke forhold ved blødning under NOAK-behandling
Plasmamåling af det specifikke NOAK er relevant, særligt ved mistanke om overdosering. Hos den truede patient afventes svar på plasmamålingen ikke før iværksættelse af behandlingstiltag. Følgende tiltag specifikt rettet mod ophævelse af effekten af en pågående NOAK-behandling kan overvejes ved alvorlig/livstruende blødning:
Antidot mod dabigatran: idarucizumab
Idarucizumab er et monoklonalt antistof, der binder dabigatran med høj affinitet og derved ophæver den antikoagulerende effekt. Behandlingen skal konfereres med trombose- og hæmostasespecialister inden anvendelse.
Antidoten bør kun anvendes ved behandling af livstruende blødning eller blødning i et kritisk organ eller aflukket rum, hvor overdosering med dabigatran er en sandsynlig årsag til blødningen. Antidoten kan også anvendes til patienter i behandling med dabigatran før akut kirurgi/invasivt indgreb med høj blødningsrisiko, som ikke kan udskydes, herunder forud for trombolyse ved akut iskæmisk apopleksi.
Indikation for anvendelse af idarucizumab skal vurderes ud fra sidste indtag af dabigatran, dosering, nyrefunktion og evt. biokemisk påvisning af dabigatrans tilstedeværelse. Undtagelser er akutte livstruende situationer, eksempelvis intrakraniel blødning eller rumperet aortaaneurisme, hvor det ikke anbefales at afvente blodprøvesvar. Idarucizumab anvendes som 5 g i.v. i to konsekutive infusioner (2 x 2,5 g/50 ml) over 5-10 minutter.
Antidot til direkte faktor Xa-hæmmer
Den specifikke antidot andexanet alfa er indtil videre ikke klinisk tilgængelig i Danmark. Ved alvorlig livstruende eller ukontrollabel blødning hos en patient i faktor Xa-hæmmer behandling kan der overvejes uspecifik reversering af den antikoagulerende effekt med protrombin kompleks koncentrat 25 IE/kg.
14.7.2 Specifikke forhold ved blødning under VKA-behandling
Ved mindre blødning overvejes reversering med phytomenadion 1-3 mg p.o. eller i.v.
Ved alvorlig og livstruende blødning kan reverseres med phytomenadion 1-10 mg p.o. eller i.v. samt protrombin kompleks koncentrat i henhold til INR (vedr. dosering henvises til Tabel 18 i DSTHs PRAB-rapport: "Perioperativ regulering af antitrombotisk behandling").
14.7.3 Specifikke forhold ved blødning under behandling med hepariner
Ved akut behandlingskrævende blødning under UFH- eller LMH-behandling overvejes muligheden for komplet (UFH) eller delvis (LMH) reversering af den antikoagulerende effekt med protaminsulfat. Protaminsulfat kan ikke reversere effekten af pentasakkarider.
Før behandling med protaminsulfat må risikoen for trombose nøje overvejes, og ofte vil en afventende strategi være et værdigt alternativ (grundet heparinernes korte halveringstid). Behandling med protaminsulfat tilrådes konfereret med koagulationsekspert.
Protaminsulfat 1 mg ophæver virkningen af 140 IE UFH og 100 IE LMH. Protaminsulfat doseres efter administreret mængde UFH/LMH og tid siden sidste administration. Ved reversering af LMH gives 0,5 mg eller 1 mg protaminsulfat pr. 100 IE LMH alt efter om seneste LMH administration er mere eller mindre end 8 timer siden. Grundet den korte halverings- og virkningstid kan der være behov for gentagen administration af protaminsulfat.
14.7.4 Genoptagelse af AK-behandling efter blødning
Genoptagelse af AK-behandling, når blødningen er under kontrol, har høj prioritet. Helt afgørende for tidspunktet er indikationen for AK-behandlingen samt blødningens sværhedsgrad og lokalisation. Sædvanligvis kan AK-behandling (f.eks. LMH i profylaksedosis) påbegyndes i første døgn efter klinisk blødningskontrol, stigende til behandlingsdoser de efterfølgende dage.
CNS-blødning kræver dog længere interval før genoptagelse af AK-behandling (ofte 4 uger). Det er en specialistopgave.
Hos patienter med atrieflimren/atrieflagren, der har oplevet alvorlig/livstruende blødning under AK-behandling, og videre AK-behandling findes kontraindiceret, kan aurikellukning overvejes.
14.8 Perioperativ regulering af AK-behandling
Beslutning om pausering eller fortsættelse af behandling (inkl. trombocytfunktionshæmmer) i forbindelse med operationer/indgreb afhænger af patientens tromboemboliske risiko, procedurens blødningsrisiko og typen af den blodfortyndende behandling.
En del indgreb med lav/moderat blødningsrisiko kan foretages uden pausering af behandlingen. Ved visse indgreb er blødningsrisikoen lav, men konsekvensen af blødning stor (intracerebral kirurgi, øjenkirurgi m.m.).
Pausens varighed afhænger af nyrefunktionen og blødningsrisikoen forbundet med indgrebet. Der anvendes IKKE bridging (dvs. en periode med overlap af to AK-præparater) med LMH hos patienter i NOAK-behandling. Ved VKA-behandling kan man overveje bridging hos patienter med høj tromboserisiko (CHA2DS2-VASc score >5, nylig VTE <3 mdr., visse mekaniske hjerteklapper, m.m.).
De overordnede principper for perioperativ håndtering af hhv. NOAK- og VKA-behandling fremgår af Tabel 14.6 og Tabel 14.7. For en mere detaljeret beskrivelse henvises til Dansk Selskab for Trombose og Hæmostase’s online bridging-applikation, der anvendes til planlægning af bridging/pausering af AK-behandling i relation til operative indgreb. Applikationen omhandler al antitrombotisk medicin. Den kan også downloades som App i App Store og Google Play. Applikationen baseres på PRAB-rapporten ("Perioperativ regulering af antitrombotisk behandling").
Tabel 14.6: Pauseringsvarighed (målt i dage) for NOAK i henhold til nyrefunktion (eGFR) og blødningsrisiko (lav eller høj) ved det planlagte indgreb. |
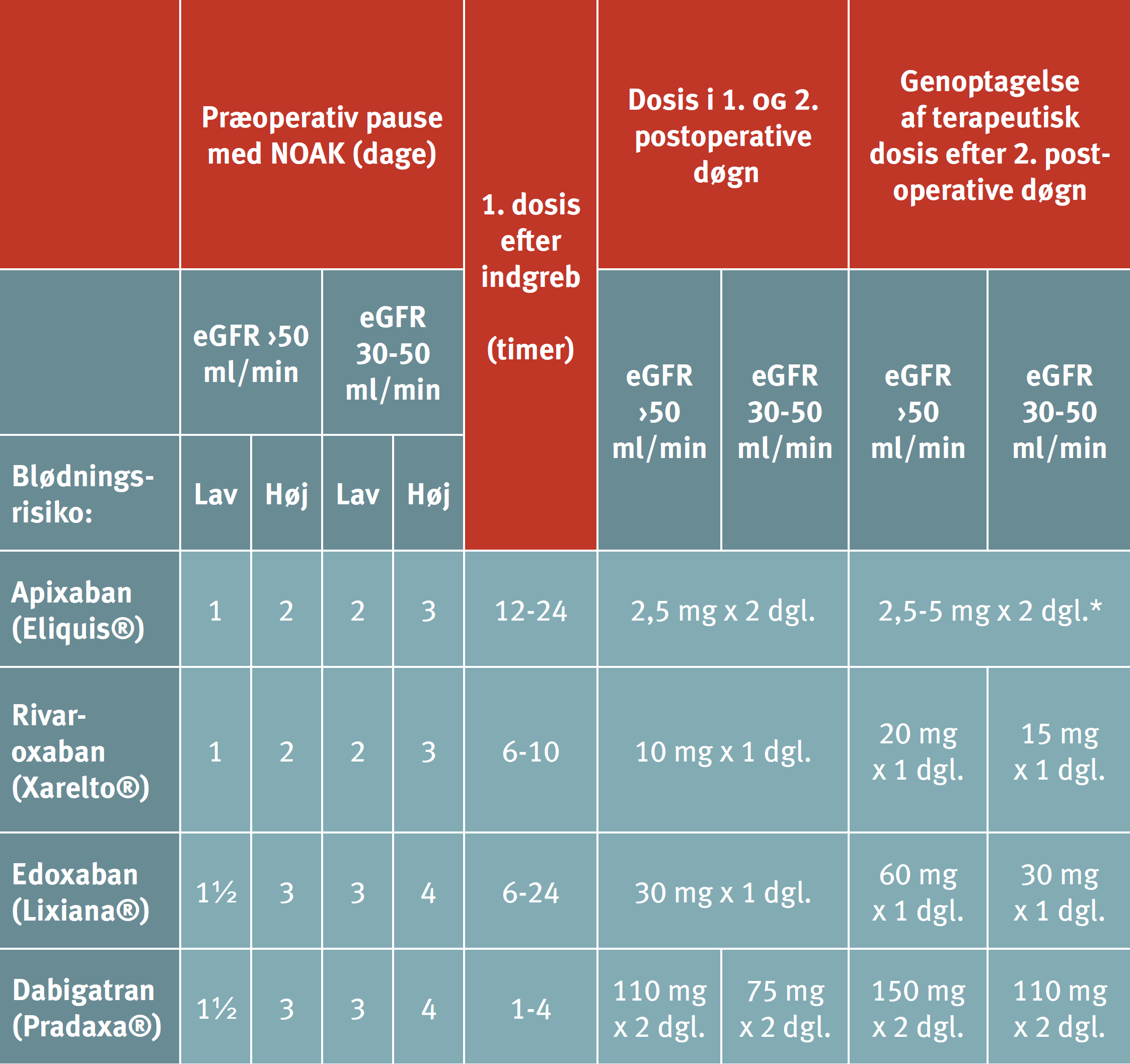 |
Tabellen er gengivet fra rapport om "Perioperativ regulering af antitrombotisk behandling" fra Dansk Selskab for Trombose og hæmostase, dsth.dk Tabellen er vejledende, og i beslutningsgrundlaget kan andre faktorer inddrages, herunder kliniske faktorer af betydning for blødningsrisikoen. Eksempler på procedurer med lav/høj blødningsrisiko er angivet i Tabel 14.7. *Giv 2,5 mg x 2 dagligt, hvis ≥2 af følgende er opfyldt: P-kreatinin >133 μmol/l, alder >80 år, vægt <60 kg |
Tabel 14.7: Perioperativ regulering af antikoagulationsbehandling med VKA |
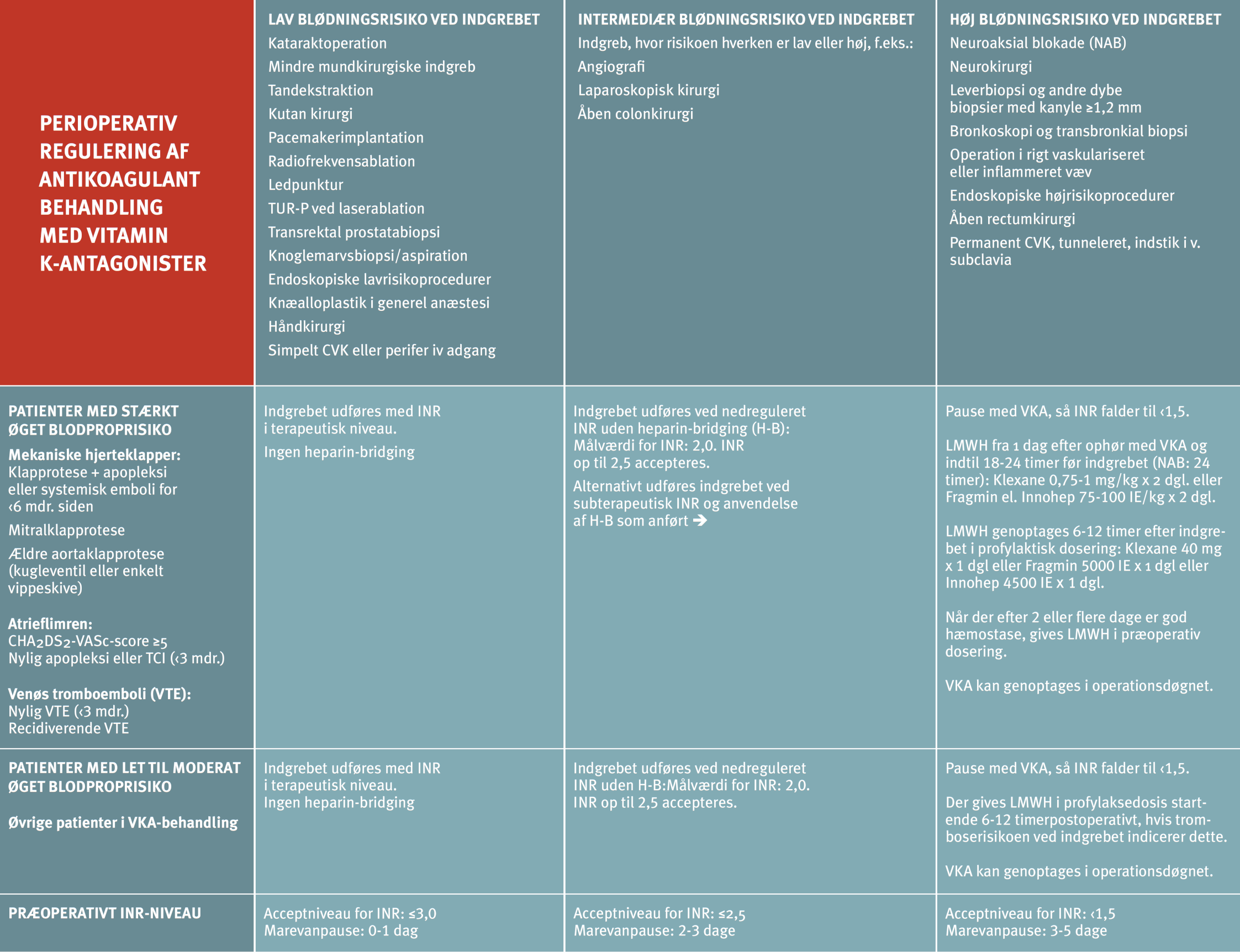 |
Tabellen er gengivet fra rapport om "Perioperativ regulering af antitrombotisk behandling" fra Dansk Selskab for Trombose og hæmostase, www.dsth.dk INR: International Normalized Ratio; VKA: Vitamin K-antagonist; LMH: Lavmolekylært heparin For CHA2DS2-VASc scoren, som skal anvendes til vurdering af tromboembolirisikoen, se Kapitel 15: Atrieflimren og atrieflagren. |
Beslutning om perioperativ AK-behandling kan baseres på ovenstående, men bør altid vurderes individuelt på basis af patientkarakteristika og procedurens karakter.
Akutte indgreb:
I akutte livstruende situationer, hvor patientens tilstand ikke tillader pausering af AK-behandlingen efter anbefalingerne angivet i ovenstående tabeller, giver det ingen mening at afvente koagulationstest. I disse tilfælde må man være forberedt på en øget blødningsrisiko ved invasive indgreb. Reversering med idarucizumab (dabigatran) eller protrombin kompleks koncentrat (apixaban, edoxaban, rivaroxaban og VKA) kan evt. anvendes efter konference med koagulationsrådgivning.
14.9 Kombinationsbehandling
NOAK og VKA må aldrig anvendes samtidigt fraset ved behandlingsskift.
Patienter må ikke være i behandling med LMH og NOAK samtidigt, heller ikke i forbindelse med bridging eller behandlingsskift.
Samtidig brug af terapeutisk AK-behandling og trombocythæmmende behandling øger blødningsrisikoen betydeligt. Fraset hos patienter med AK-indikation og nyligt AKS er kombinationsbehandling sjældent indiceret. Flerstofs-antitrombotisk behandling bør derfor altid føre til en overvejelse af, om der reelt er indikation herfor.
I nedenstående er nævnt overvejelser vedrørende kombinationsbehandling i specifikke patientgrupper:
Patienter med iskæmisk hjertesygdom og indikation for terapeutisk AK-behandling
Ved kronisk iskæmisk hjertesygdom gives som hovedregel udelukkende AK-behandling.
Vedrørende dobbeltterapi (AK-behandling og trombocytfunktionshæmmer) og tripleterapi (AK-behandling og to trombocytfunktionshæmmere) efter AKS eller elektiv PCI, se Kapitel 1: Akut koronart syndrom, Afsnit 1.6.7 og Kapitel 3: Kronisk koronart syndrom, Afsnit 3.6.1.
Patienter med mekanisk hjerteklap
Kombination af VKA og acetylsalicylsyre er indiceret hos patienter med emboli på trods af relevant AK-behandling se Kapitel 6: Hjerteklapsygdom, Afsnit 6.8
Patienter med tidligere apopleksi og indikation for terapeutisk AK-behandling
Ved indikation for terapeutisk AK-behandling hos patienter i trombocythæmmende behandling pga. tidligere apopleksi seponeres den trombocythæmmende behandling. Behandling med NOAK foretrækkes frem for VKA hos patienter med atrieflimren og tidligere apopleksi på grund af lavere risiko for blødning, herunder intrakraniel blødning.
Patienter med kronisk iskæmisk hjertesygdom eller symptomatisk perifer arteriesygdom og høj risiko for iskæmisk komplikation
Hos patienter med høj iskæmisk risiko og lav blødningsrisiko kan der være indikation for at kombinere ASA med lavdosis AK-behandling i form af rivaroxaban 2,5 mg x 2 dagligt. Se (Se Kapitel 6: Kronisk koronart syndrom og Kapitel 33: Perifer arteriesygdom).
Ved indikation for terapeutisk AK-behandling gives dette i monoterapi.
14.10 AK-behandling i specielle patientgrupper
Patientspecifikke forhold kan føre til ændret farmakokinetik, øget blødningsrisiko eller andre særlige risici ved AK-behandling, der nødvendiggør en individualiseret behandling i forhold til såvel dosering som præparatvalg. Overordnede anbefalinger relateret til AK-behandling i udvalgte patientgrupper fremgår af Tabel 14.8. Konference med ekspert (fagområdespecialist i Trombose og Hæmostase, nefrolog, hepatolog, farmakolog mv.) kan overvejes.
AK-behandling af patienter med cancerassocieret trombose omtales grundigt i Kapitel 12: Lungeemboli og dyb venetrombose, Afsnit 12.4. Ved atrieflimren/atrieflagren hos patienter med cancer kan NOAK eller LMH anvendes med samme forbehold som beskrevet i Kapitel 12. I de tilfælde, hvor der vælges LMH til patienter med atrieflimren, anvendes en dosis svarende til ved VTE eller lidt mindre, da patienter med atrieflimren ikke (som VTE-patienter) har manifest trombose, men kun har risiko for trombose. For dalteparin anbefales pragmatisk en dosis på 150 IE/kg ved atrieflimren.
AK-behandling af præmenopausale kvinder er associeret med en ikke ubetydelig risiko for kraftige og langvarige menstruationer (menoragi). Rivaroxaban og edoxaban synes at være behæftede med en højere risiko for menoragi end apixaban, dabigatran og warfarin. Risikoen for AK-associeret menoragi kan reduceres ved samtidig hormonel antikonceptiv behandling. Hormonspiral eller minipiller er at foretrække, men P-piller kan accepteres, så længe kvinden er i AK-behandling, også på trods af østrogenassocieret VTE.
Patientgruppe | FXa-hæmmere* | Dabigatran | Warfarin | LMH |
|---|---|---|---|---|
Gravide | Kontraindiceret | Kontraindiceret | Frarådes grundet malformationsrisiko. Kan om nødvendigt anvendes fra 12. til 36. gestationsuge. | Kan anvendes. Dosis justeres efter prægravid vægt. |
Ammende | Kontraindiceret | Kontraindiceret | Anvendes som vanligt | Anvendes som vanligt |
Overvægtige | Kan anvendes. Ved BMI ≥40 kg/m2 overvejes måling af P-NOAK mhp. vurdering af effektivitet, alternativt skift til VKA. | Anvendes som vanligt | Vægt >120 kg: Enoxaparin eller tinzaparin er førstevalg. BMI ≥40 kg/m2: Ved længerevarende behandling overvejes anti-Xa-måling | |
Nedsat nyrefunktion** | Dosisreduceres jf. Tabel 14.3. eGFR <15 ml/min: kontraindiceret | eGFR 30-50 ml/min: overvej dosisreduktion. eGFR <30 ml/min: kontraindiceret | Anvendes som vanligt | Profylaksedoser: som udgangspunkt ingen dosisjustering Terapeutisk dosering: se Tabel 14.4 |
Aktiv cancer | Kan anvendes under hensyntagen til antineoplastisk behandling, nyrefunktion og cancer-type.*** Rivaroxaban og edoxaban frarådes ved urogenital og gastrointestinal cancer. Apixaban kan anvendes fraset ved intakte luminale tumorer i øvre GI-kanal. | Frarådes pga. manglende data | Frarådes (kan om nødvendigt anvendes, fx ved mekaniske klapper) | Anvendes som vanligt. Ved VTE kan dalteparin dosisreduceres efter 1 mdr. fra 200 til 150 IE/kg |
Nedsat leverfunktion**** | Child-Pugh score*****: A: Anvendes som vanligt B: Forsigtighed tilrådes. Rivaroxaban kontraindiceret. C: Kontraindiceret | Child-Pugh score*****: A: Anvendes som vanligt B: Forsigtighed tilrådes C: Kontraindiceret Monitorering med INR kan dog være vanskeligt. | Kan anvendes. Ved behov for terapeutisk dosering hos patient med svær leverinsufficiens og betydende koagulationsdefekt rådføres med hepatolog. | |
Trombocytopeni (ikke HIT-relateret) | Trombocyttal >50x109/l: Normal dosering Trombocyttal 20-50x109/l: Halver dosis Trombocyttal <20x109/l: kontraindiceret | Trombocyttal <100x109/l: INR lavt i det terapeutiske interval Trombocyttal <50x109/l: Frarådes, konferer med hæmostaseekspert | Profylaksedoser: pauseres/undlades ved trombocytter <50 x109/l Terapeutisk dosering******: Trombocyttal 30-50x109/l: halver dosis Trombocyttal < 30x109/l: kontraindiceret | |
*Apixaban, edoxaban og rivaroxaban **Ved svært nedsat nyrefunktion (eGFR<15 ml/min, dialyse) overstiger risikoen for blødning på AK-behandling potentielt risikoen for trombose uden AK-behandling. AK- behandling af denne population bør derfor nøje overvejes under vurdering af tromboserisikoen, evt. i samarbejde med nefrolog. ***Der henvises til Medicinrådets behandlingsvejleding på området, særligt behandlingsalgoritmen på side 8 samt afsnit 5.6.6. om lægemiddelinteraktioner ****Blødningstruede øsofagusvaricer behandles forud for opstart af AK-behandling hvis muligt. *****Se f.eks. www.pro.medicin.dk - Nedsat leverfunktion ******Ved nyopståede, alvorlige tromboser anbefales dog terapeutisk LMH-dosering i den første måned trods trombocyttal på 30-50 x 109/l. Ved lavere trombocyttal anbefales optransfusion til trombocyttal >30 x 109/l i kombination med halv dosis LMH. | ||||




