3. Kronisk koronart syndrom
3.1 Definition
Insufficient myokardieperfusion på baggrund af koronar aterosklerose/stenose, koronarspasme eller mikrovaskulær sygdom medførende myokardieiskæmi. Tilstanden kan optræde sekundært til hjerteklapfejl, kardiomyopati, hypertension, hypotension, hypoksi, takykardi eller anæmi.
Kronisk koronart syndrom (KKS) kan præsentere sig på mange forskellige måder som beskrevet i afsnittet om symptomer. Symptomerne kan ligne dem som optræder ved akut koronart syndrom (AKS), men de optræder i et stabilt mønster – typisk ved aktivitet.
3.2 Forekomst
Prævalensen er ca. 165.000 personer i Danmark.
3.3 Ætiologi
KKS er hyppigst forårsaget af aterosklerose i koronararterierne. Myokardieiskæmi opstår i situationer, hvor der er ubalance mellem hjertets iltbehov og iltforsyning.
3.4 Symptomer
Tilstanden erkendes og beskrives forskelligt fra person til person, men kardinalsymptomet er angina pectoris.
Beskrivelse
- Brystsmerter omfatter trykkende, pressende, klemmende smerter eller ubehag; klassisk illustreret af patienten med en knyttet hånd foran sternum og beskrevet som tyngdefornemmelse på patientens brystkasse.
- Åndenød kan optræde samtidig med brystsmerter, men kan også være eneste symptom på KKS (anginaækvivalent).
- Symptomer i venstre eller højre side af brystet, i form af stik, svien, skarpe smerter eller ubehag i halsen eller abdomen og kvalme kan også forekomme, især hos kvinder og ældre patienter samt patienter med diabetes.
Lokalisation
- Typisk retrosternalt.
- Undertiden alene i epigastriet, kæbe, hals, nakke eller overekstremiteter.
- Udstråling til hals, kæbe og tænder, aksil, ryg, venstre og/eller højre arm.
Provokerende og lindrende faktorer
- Provokeres ved fysisk/psykisk belastning og/eller kulde.
- Lindres ved hvile, nitroglycerin eller anden antianginøs medicinering.
Tærskel og hyppighed
- Lavere tærskel om morgenen, i kulde eller efter måltider.
- Canadian Cardiovascular Society-klasse 1-4 (CCS-klasse) beskriver, ved hvilket aktivitetsniveau angina optræder. CCS-klassifikation anvendes udelukkende ved typisk angina.
Varighed
- Typisk bygges symptomerne langsomt op og aftager i løbet af minutter efter hvile eller nitroglycerin.
- Meget kortvarige (sekunder) eller længerevarende symptomer er almindeligvis ikke manifestationer af KKS, men kan f.eks. være udtryk for ikke-kardiel patologi eller akut koronart syndrom (AKS).
| |
Typisk angina | opfylder alle tre ovenstående kriterier |
Atypisk angina | opfylder to af ovenstående kriterier |
Uspecifikke brystsmerter | opfylder ingen eller et af ovenstående kriterier |
3.5 Udredning
En skematisk fremgangsmåde kan benyttes i udredning af patienter ved mistanke om KKS (Figur 3.1). En grundig anamnese med vægt på symptomer (se Afsnit 3.4), risikofaktorer og klinisk undersøgelse er grundstenen i udredningen.
Vurdering af patientens komorbiditet, livskvalitet og afstemning af behandlingsønsker er vigtigt tidligt i forløbet for at undgå unødvendige undersøgelser.
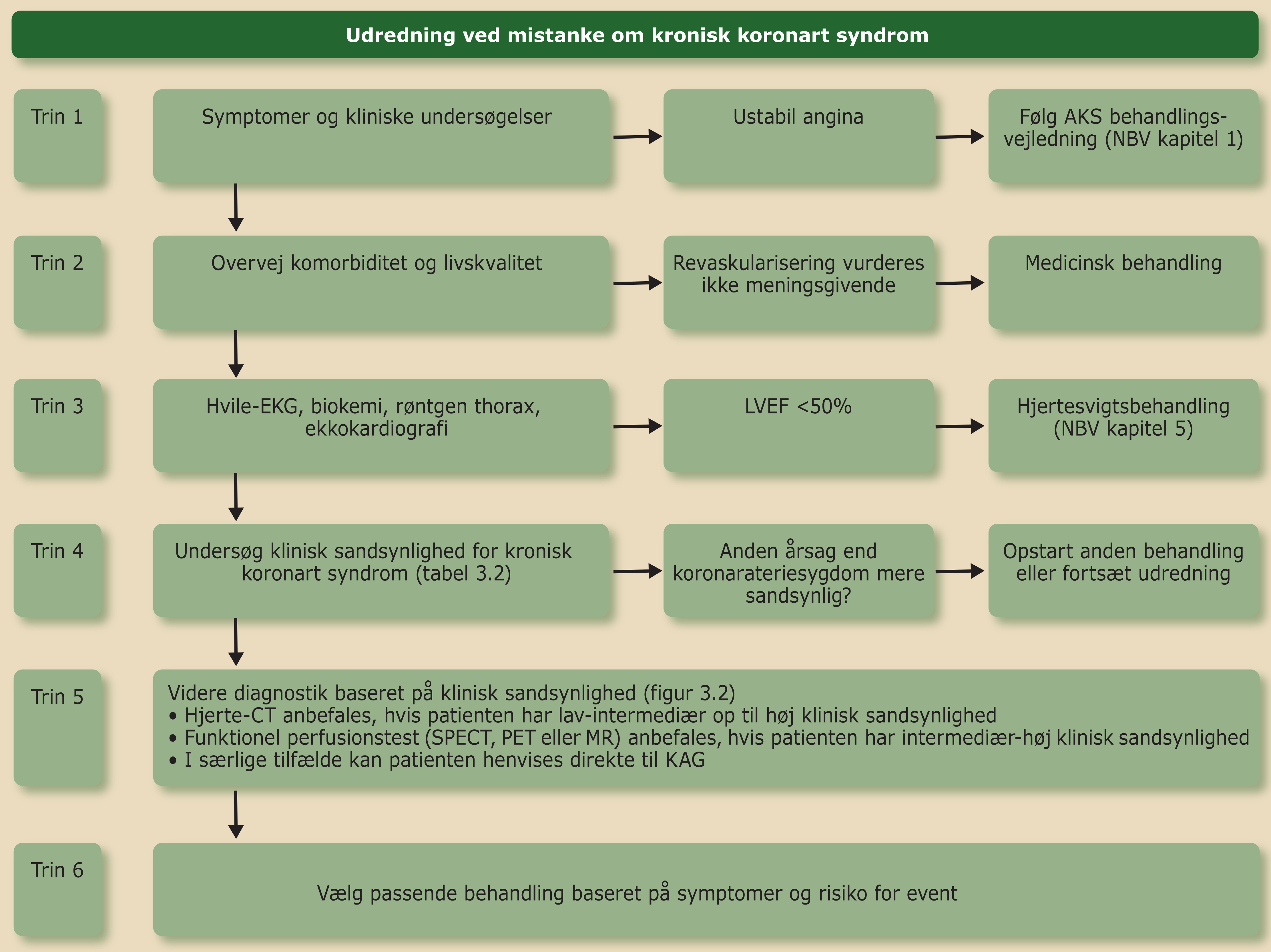 |
Tidligt i udredningen tages EKG, biokemi (Hgb, K, Na, kreatinin, glukose, HbA1c, total-kolesterol, HDL, LDL, triglycerid og TSH) og der foretages ekkokardiografi. Ekkokardiografi udføres m.h.p. at identificere differentialdiagnostiske årsager og vælge den rette udrednings- og behandlingsstrategi. Der lægges vægt på venstre ventrikels funktion med angivelse af hypokinetiske områder samt hjerteklapfejl og pulmonaltryk.
Lungefunktionsundersøgelse og røntgen af thorax kan være vigtige til differentialdiagnostisk afklaring.
Den kliniske sandsynlighed for KKS kan estimeres ved brug af en prædiktionsmodel inkluderende patientens alder, køn og risikofaktorer (familiær disposition til iskæmisk hjertesygdom, rygning, dyslipidæmi, hypertension, diabetes) (Tabel 3.2).
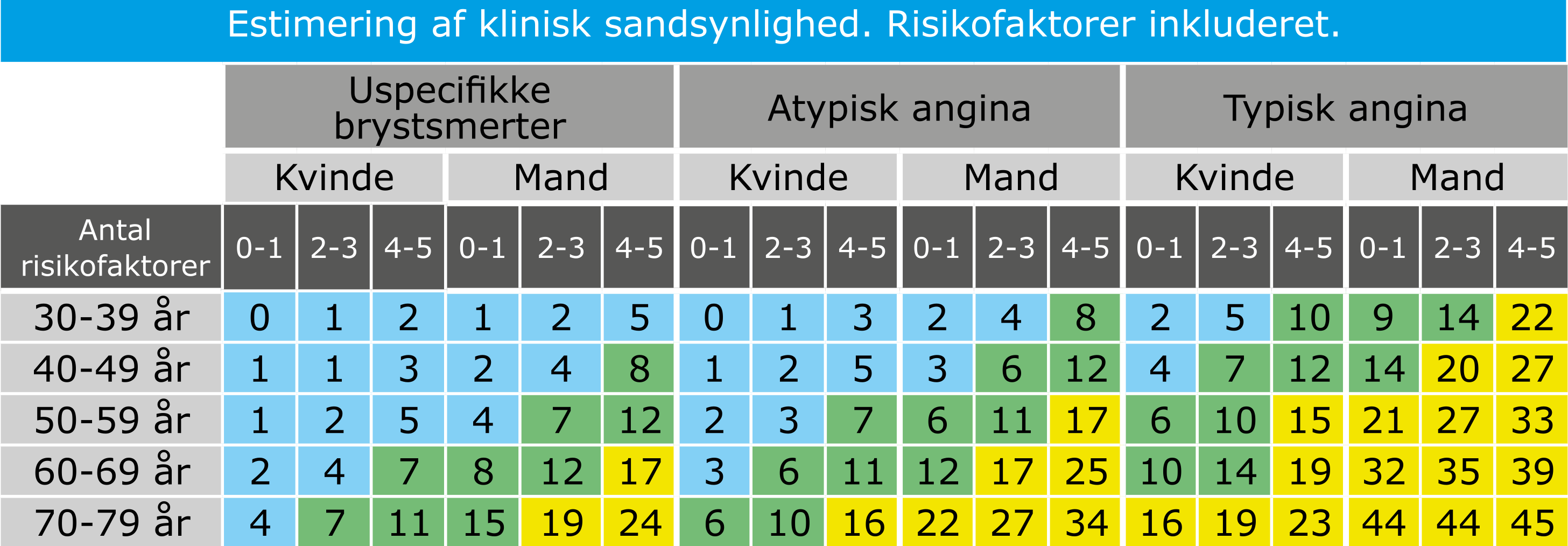 |
Risikofaktorer: Familiær disp., rygning, dyslipidæmi, hypertension, diabetes Lyseblå: lav klinisk sandsynlighed, Grøn: intermediær klinisk sandsynlighed, Gul: intermediær-høj klinisk sandsynlighed for KKS. Enhed: procent. |
Den kliniske sandsynlighed kan yderligere modificeres ud fra tilstedeværelse af nedenstående:
- EKG-forandringer (Q-tak eller ST-/T-tak deviationer)
- regional systolisk dysfunktion af venstre ventrikel
- tidligere hjerte-CT eller evt. anden CT-scanning med tegn til koronar kalcifikation
Generelt bør patienter med klinisk sandsynlighed ≤5% ikke udredes yderligere for KKS (Tabel 3.2). Patienter med klinisk sandsynlighed i intervallet 6-15% kan evt. udredes, mens patienter med klinisk sandsynlighed >15% som udgangspunkt bør udredes non-invasivt. Bemærk at koronarangiografi (KAG) meget sjældent er den primære undersøgelse, og at kun få patienter bør henvises direkte til KAG. Det gælder f.eks. patienter med kendt iskæmisk hjertesygdom eller meget høj klinisk sandsynlighed for dette, samt patienter med helt særlige forhold, f.eks. nylig revaskularisering (Figur 3.2).
Valget af undersøgelsesmodalitet afhænger dels af patientens kliniske sandsynlighed, dels af hvilken modalitet, der er bedst egnet for patienten under hensyntagen til f.eks. vægt, arytmi, nyrefunktion, lungesygdom etc. og endelig lokale forhold (tilgængelighed og ekspertise) (Figur 3.2).
| Figur 3.2: Valg af undersøgelsesmodalitet ved udredning |
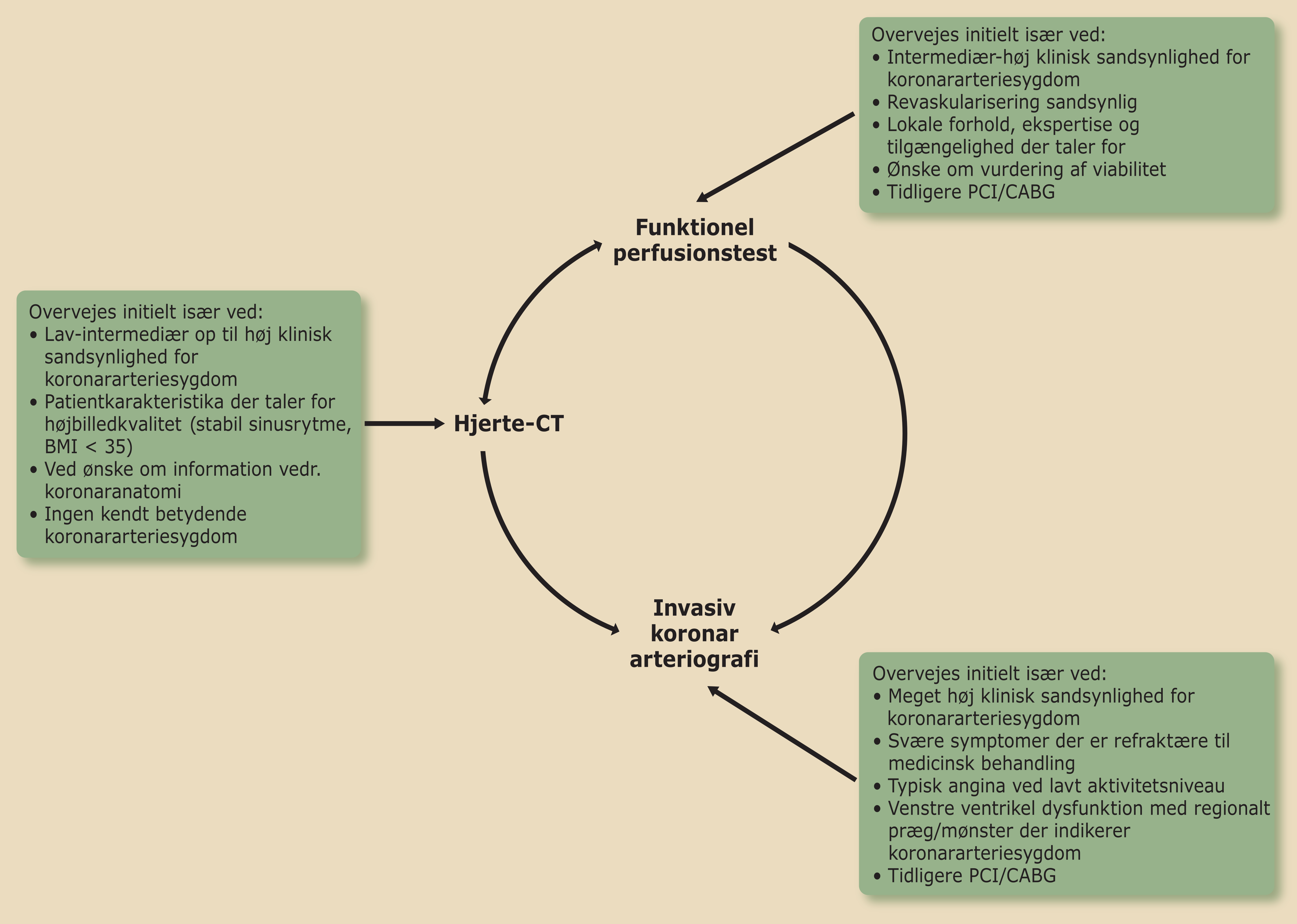 |
Hjerte-CT anbefales, hvis patienten har lav til intermediær og i nogen tilfælde ved høj klinisk sandsynlighed.
Funktionel perfusionstest (single photon emission computed tomography (SPECT), positron emission tomography (PET) eller magnetisk resonans (MR)) anbefales, hvis patienten har intermediær til høj klinisk sandsynlighed og hvis hjerte CT ikke kan udføres eller er inkonklusiv (Tabel 3.2).
Arbejdstest anbefales ikke til iskæmiudredning, men kan anvendes til vurdering af anstrengelsesudløst arytmi eller ved tvivl om symptomatologi.
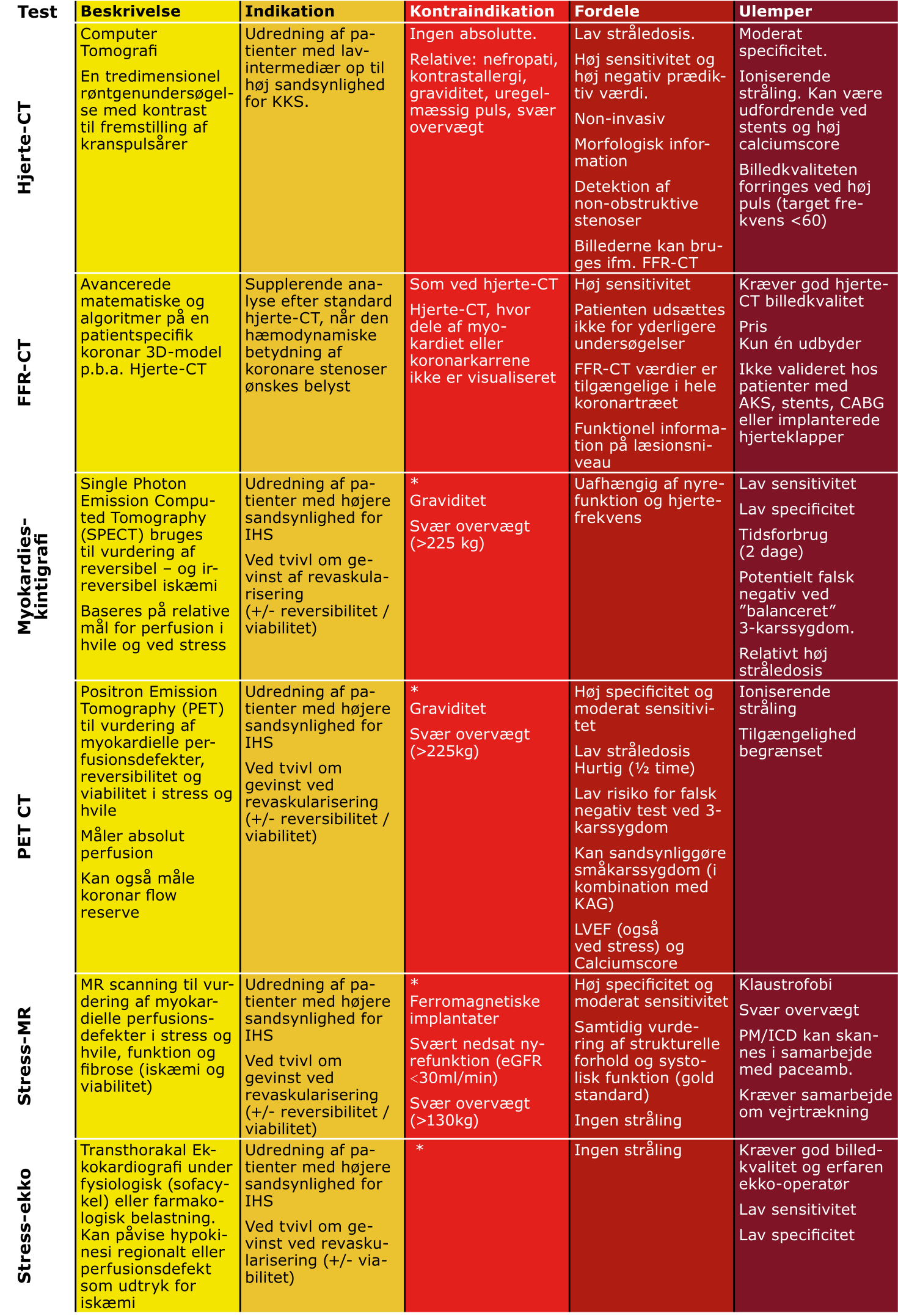
Individuelle fordele og ulemper for de enkelte non-invasive undersøgelser omtales i Tabel 3.3.
Ved konklusiv non-invasiv undersøgelse uden mistanke om KKS bør patienten generelt ikke have foretaget yderligere diagnostiske iskæmiundersøgelser. Ved inkonklusiv non-invasiv undersøgelse kan testen enten gentages eller suppleres af en anden non-invasiv undersøgelse. I sjældne tilfælde henvises direkte til KAG.
Hjerte-CT
Ved hjerte-CT med god billedkvalitet visende intermediær stenose med potentiel mulighed for revaskularisering bør der udføres funktionstest forud for henvisning til KAG. I Danmark anvendes både PET-CT, myokardieskintigrafi, FFR-CT, stress-MR og stress-ekko til dette formål.
Ved konklusiv hjerte-CT med tegn på betydende hovedstammestenose, proksimal svær stenose eller betydende flerkarssygdom bør patienten henvises direkte til KAG. Ved svær stenose på mere distale større kar kan det overvejes at henvise til KAG afhængig af symptomatologi og patientønske.
Koronarangiografi
Ved KAG fremstilles koronaranatomien ved røntgengennemlysning og samtidig kontrastinjektion i koronararterierne via kateter indført gennem a. radialis eller a. femoralis, i sjældnere tilfælde a. ulnaris eller a. brachialis.
KAG giver en morfologisk beskrivelse af koronararterierne herunder stenoser, dissektioner, trombose og kalcifikation. Stenosegrader ≥90% i større kar anses for sikkert iskæmigivende. Ved tvivl om hvorvidt en stenose er iskæmigivende, typisk stenoser i intervallet 50-90%, bør der suppleres med intravaskulær trykmåling. Hos patienter uden betydende stenoser, men med relevante symptomer, kan der suppleres med invasiv måling af koronar flow reserve og mikrovaskulær modstand (obs. mikrovaskulær sygdom) eller acetylkolintest (obs. spasmeangina).
Indikation for KAG:
Kun få patienter bør henvises direkte til KAG. Det gælder f.eks. patienter med meget høj klinisk sandsynlighed for iskæmisk hjertesygdom (se Figur: 3.2).
Ved positive fund ved non-invasiv udredning kan patienten henvises til KAG. Det gælder f.eks.:
- Ved Hjerte-CT med tegn på betydende hovedstammestenose, proksimal svær stenose eller betydende flerkarssygdom bør patienten henvises direkte til KAG.
- Ved svær stenose på mere distale større kar kan det overvejes at henvise til KAG afhængig af symptomatologi og patientønske.
- Når non-invasiv funktionel iskæmiudredning har givet mistanke betydende myokardieiskæmi.
Henvisning til KAG/percutan coronar intervention (PCI):
- Patienter henvist til KAG (der ikke er i AK-behandling) bør opstartes i behandling med acetylsalicylsyre (ASA) 75mg x 1.
- Ved behandling med vitamin K-antagonister (VKA) tilstræbes INR <2,5.
- Behandling med non-vitamin K-antikoagulantia (NOAK) kan pauseres 24 timer før elektiv KAG (KAG kan dog gennemføres trods pågående NOAK-behandling).
Generelt anbefales radial adgang for at minimere peri- og postprocedurerelaterede blødningskomplikationer.
Restriktioner efter KAG:
- Bilkørsel frarådes de første to dage efter a. femoralis adgang og på undersøgelsesdagen efter a. radialis adgang.
- Let fysisk aktivitet (max. løft 2-4kg, cykling/anden sport) frarådes de første to dage.
- Tungere løft og hårdt fysisk arbejde frarådes de første fire dage.
Udskrivelse:
- Ved ukompliceret procedure og mobilisering kan patienten udskrives samme dag 2-3 timer efter KAG og fire timer efter PCI (både ved radial og femoral adgang)
Komplikationer:
Den samlede risiko for komplikationer ved KAG er under 1%, idet risikoen:
- For død er <0,1%.
- For AMI <0,2%.
- For cerebral emboli (apopleksi eller TIA) <0,1%.
- For arteriel komplikation (blodtransfusion, pseudoaneurisme, karkirurgisk intervention, retroperitonealt hæmatom) er ca. 0,2% ved radial adgang og ca. 0,8% ved femoral adgang.
- For allergiske reaktioner inkl. anafylaktisk shock <0,1%.
Risikoen for større komplikationer ved PCI er beskeden og varierer med grundmorbus og koronaranatomi, ligesom risikoen ved akut intervention naturligvis er større end ved elektiv behandling.
- Risikoen for død 30 dage efter elektiv PCI er ca. 0,4%.
Behandling af komplikationer:
Ved komplikationer til KAG/PCI anbefales generelt, at udredning og evt. videre behandling varetages i samråd med den afdeling, der har udført indgrebet.
- Hos en akut påvirket patient, hvor der er mistanke om retroperitoneal blødning, intrathorakal blødning eller dissektion, bør der udføres akut CT-scanning af abdomen og/eller thorax.
- Blødning/hæmatom fra indstikssted
- Primært sikres hæmostase (kompression). Indgift af væske og blodprodukter efter vanlige principper. Da der er tale om blødning på mekanisk baggrund, bør denne kunne stoppes ved kompression, hvorved man kan undgå indgift af blodprodukter, som kan fremme trombosetendensen i de behandlede koronararterier.
- Pseudoaneurisme
- Et pseudoaneurisme udgår fra stikkanalen i a. radialis eller a. femoralis efter KAG eller PCI. Det drejer sig om et kunstigt dannet "hulrum" pga. persisterende defekt i arterievæggen. Aneurismevæggen udgøres af det omkringliggende væv.
- Symptomerne er kraftig palpationsømhed omkring indstiksstedet. Det kan opstå pludseligt, og viser sig oftest ved en lokaliseret, pulserende udfyldning. Diagnosen stilles ved ultralydsscanning.
- Hvis symptomerne opstår efter udskrivelse, bør patienten vurderes akut på sygehus (optimalt på sygehus med erfaring i udredning og behandling af indstikskomplikationer).
- Indtil behandlingen er tilendebragt, skal pt. være sengeliggende ved pseudoaneurisme udgående fra a. femoralis.
- Behandlingen er en specialistopgave og består af én af flere forskellige kompressionsmetoder, trombin-injektion eller sjældnere åben karkirurgi.
- Okklusion af a. radialis
- Er oftest asymptomatisk og kræver ikke behandling. Ved symptomer i form af hævelse, misfarvning og smerte sv.t. overekstremiteten kontaktes karkirurg. Diagnosen stilles ved ultralydsscanning (indledningsvis ved reverse Barbeau test).
- Cerebrovaskulært insult
- Ved klinisk mistanke om procedure-relateret apopleksi under eller efter KAG/PCI stiles mod hurtigst mulig reetablering af perfusionen m.h.p. at minimere den cerebrale skade.
- Udredning og behandling afviger ofte fra vanlig procedure ved apopleksi, da patienter, der er hepariniseret i forbindelse med KAG/PCI, som udgangspunkt ikke er trombolyse-kandidater, hvis symptomer opstår under eller umiddelbart efter procedure.
- Ved nyopståede neurologiske udfald uden tegn på hurtig remission i forløbet af invasive kardiologiske procedurer kontaktes vagthavende endovaskulær trombektomi (EVT) - eller trombolysevagt m.h.p. akut scanning og eventuel trombektomi/trombolyse. Det præcise forløb og valg af modalitet afhænger af lokale forhold.
- CT af cerebrum overvejes primært, hvis blødning mistænkes.
3.6 Behandling
KKS medfører forringet livskvalitet, forøget morbiditet og mortalitet, og derfor er der behov for:
- primær behandling mhp. bedring af symptomer og prognose
- sekundær profylakse/rehabilitering m.h.p. bedring af symptomer og prognose
3.6.1 Prognostisk behandling
Medikamentel behandling
Antitrombotisk behandling
- ASA 75mg x 1 bør gives livslangt til alle patienter med betydende koronar aterosklerose, medmindre det er kontraindiceret. Ved dyspeptiske gener suppleres med protonpumpehæmmer (PPI).
- Tåles ASA ikke, anvendes clopidogrel 75mg x 1.
- Når mistanken om KKS er rejst, kan ASA 75mg x 1 og evt. statinpræparat opstartes baseret på ventetiden til diagnostisk afklaring og vurdering af sandsynligheden for iskæmisk hjertesygdom. ASA bør ordineres forud for udredning med KAG, såfremt der ikke findes kontraindikation herfor.
Primær profylaktisk antitrombotisk behandling hos patienter uden dokumenteret iskæmisk hjertesygdom anbefales ikke generelt på grund af øget risiko for blødning.
Hos patienter med diabetes og meget høj risiko for hjertekarsygdom (med mikroalbuminuri/nefropati) anbefales ASA 75mg x 1. Se også Kapitel 26: Diabetes og Hjertesygdom.
Dual Anti Platelet Therapy (DAPT)
Efter PCI gives clopidogrel 75mg x 1 i seks måneder ud over ASA 75mg x 1 (se nedenfor). Prasugrel eller ticagrelor anvendes kun efter PCI ved kronisk iskæmisk syndrom, hvis patienten ikke tåler clopidogrel og i særlige tilfælde ved kompleks PCI eller mistanke om manglende clopidogrel-respons (f.eks. ved tidligere stent-trombose under clopidogrelbehandling).
Alle patienter (også patienter i monoterapi) med høj risiko for gastrointestinal blødning bør behandles med PPI, f.eks. pantoprazol eller lansoprazol – men ikke omeprazol (se i øvrigt Kapitel 1: Akut koronart syndrom, Afsnit 1.6.9 Protonpumpe hæmmer (PPI) behandling).
Der sker en tiltagende individualisering af behandlingsvarigheden under hensyn til bl.a. PCI-procedure (fx antal, længde og placering af stents), koronarpatologi, samtidig blodfortyndende behandling eller tidligere stent-trombose. Det er vigtigt, at den af PCI-centret fastsatte behandlingsvarighed overholdes, og at evt. pausering eller forkortning af behandlingsperioden med clopidogrel drøftes med PCI-center.
Til patienter med KKS og markant forhøjet risiko for kardiovaskulære events (f.eks. patienter med tidl. AMI, signifikant flerkarssygdom eller PAD) samt normal/lav risiko for blødning, kan man overveje behandling med ASA + rivaroxaban 2,5mg x 2 efter ophørt DAPT behandling. Forsigtighed ved alder >75 år og ved vægt <60 kg. Tidligere apopleksi/TIA er kontraindikation. Behandlingen bør altid konfereres med speciallæge i kardiologi.
Patienter behandlet med PCI med samtidig indikation for VKA/NOAK:
Efter PCI foretages en afvejning af risikoen for kardiovaskulært event over for risikoen for blødning. Figur 3.3 viser en algoritme, der guider valget af den blodfortyndende behandling. Behandlingsvalget foretages som udgangspunkt af PCI-operatøren.
Generelt gælder, at triple-terapi skal gives i kortest mulig tid. De fleste patienter skal som udgangspunkt behandles en uge med ASA, og med clopidogrel og VKA/NOAK i seks mdr. (Figur 3.3). Varigheden af ASA-behandling afhænger af risiko for blødning vs. risiko for kardiovaskulært event. I enkelte tilfælde kan ASA helt undlades. Ved behov for antikoagulerende behandling pga. f.eks. atrieflimren bør man vælge NOAK fremfor VKA i tillæg til behandling med trombocythæmmer pga. den lavere risiko for store blødninger, herunder intrakraniel blødning. Dette gælder dog ikke situationer, hvor der er indikation for antikoagulerende behandling, men hvor NOAK p.g.a. eksempelvis mekanisk hjerteklap, svært nedsat nyrefunktion eller andre forhold er kontraindiceret.
Der bør på lav tærskel gives profylaktisk PPI-behandling, så længe AK-behandling gives sammen med ASA og/eller clopidogrel.
Se også Kapitel 1: Akut koronart syndrom, Afsnit 1.6.9 Protonpumpe hæmmer (PPI) behandling samt Kapitel 14: Antikoagulationsbehandling vedr. fordele/ulemper og praktiske forhold ved behandling med VKA og NOAK.
Figur 3.3: Patienter med kronisk koronart syndrom - med samtidig indikation for VKA/NOAK |
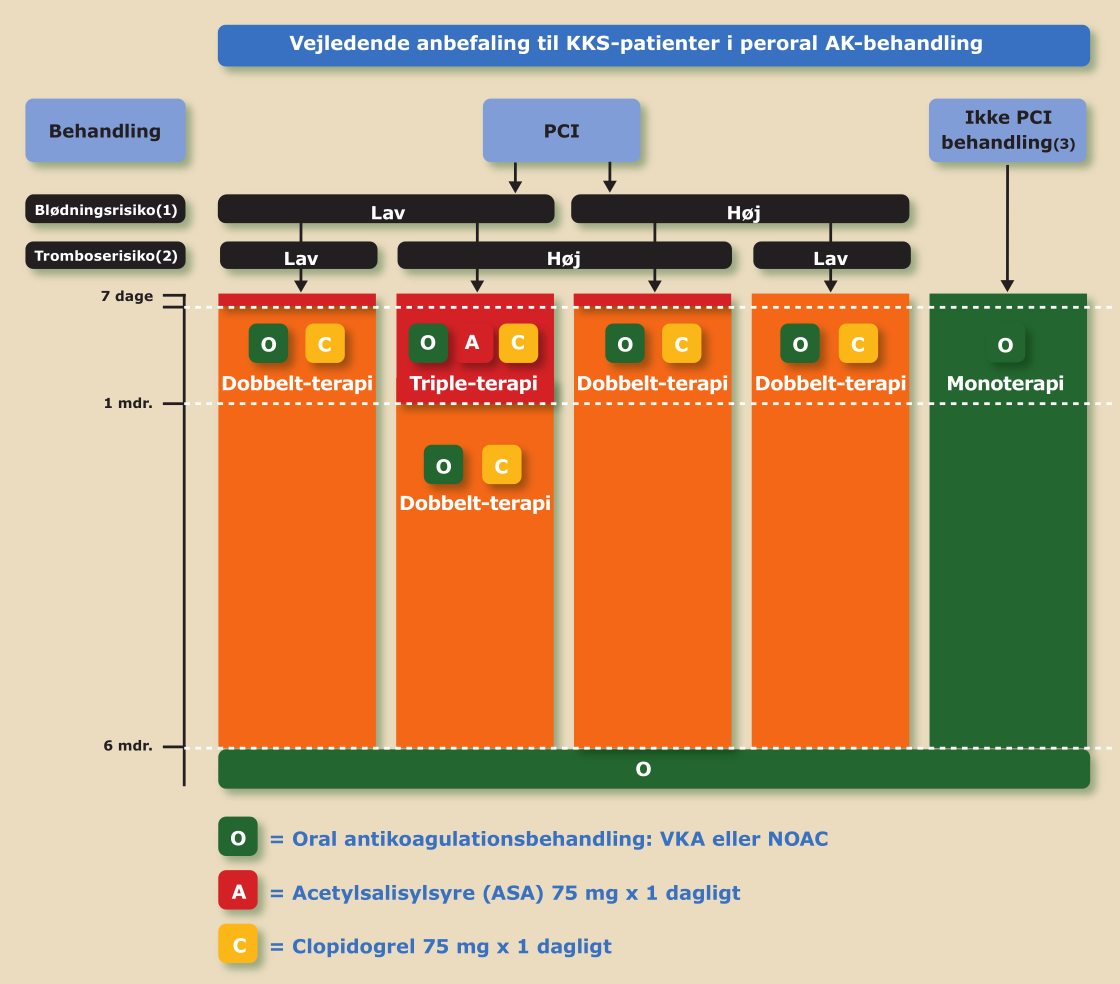 |
(1) Blødningsrisiko: kan bl.a. vurderes ved risikoscores som PRECISE-DAPT, Crusade bleeding score og ARC-HBR. Se Kapitel 15: Atrieflimren og Atrieflagren, Tabel 15.4 og PRECISE-DAPT. ARC-HBR kan beregnes på tilgængelig app (iOS, Android). (2) Øget tromboserisiko: DM, PAD, nyreinsufficiens, gentagne AMI'er, tidligere stent-komplikation, kompleks koronar-patologi og/eller komplekse procedureforhold. (3) CABG patienter: Se nedenfor. |
Ved indikation for langvarig AK-behandling kan man følge samme principper som anført for atrieflimren (se Kapitel 15: Atrieflimren og atrieflagren, Afsnit 15.5.2) med anvendelse af enten VKA eller NOAK. Med hensyn til dosering af NOAK i kombination med ASA/clopidogrel henvises til Kapitel 1: Akut koronart syndrom, Afsnit 1.6.7.
Efter PCI-behandling med samtidig indikation for AK-behandling med VKA bør INR ligge lavt i terapeutisk niveau. Se i øvrigt Kapitel 14: Peroral antikoagulansbehandling.
Patienter, der får foretaget koronar bypass operation (CABG) og har indikation for AK behandling bør behandles med ASA og VKA/NOAK. Såfremt patienten vurderes til at være i øget blødningsrisiko (se Figur 3.3) kan trombocythæmmer (ASA) behandlingen seponeres, dog anbefales dette tidligst efter seks mdr. (medmindre der ses blødningskomplikationer).
Lipider
- Statin bør gives til alle patienter med KKS.
- LDL målet for disse højrisikopatienter er <1,4 mmol/l.
- Ved LDL i intervallet 1,4 –2,8 mmol/l anbefales dog mindst 50% reduktion af LDL.
- Der indledes med et potent præparat i høj dosis; almindeligvis atorvastatin 80mg x 1.
- Ved behov for yderligere behandling kan statin suppleres med kolesterolabsorptionshæmmeren ezetimibe 10mg x 1.
- Moderat forhøjede plasmaniveauer af triglycerider indebærer en øget risiko for udvikling af hjertekarsygdom, og yderligere udredning og behandling (overvejende non-farmakologiske tiltag) anbefales.
- Lavt HDL-kolesterol er stærkt associeret med udvikling af hjertekarsygdom, men synes ikke at være en kausal risikofaktor, se i øvrigt Kapitel 28: Dyslipidæmi.
Se i øvrigt Kapitel 5: Kronisk hjertesvigt samt Kapitel 34: Forebyggelse af hjertesygdom.
Risikofaktor- og livsstilsmodifikation
Alle patienter med KKS skal tilbydes et ambulant rehabiliteringsforløb med fokus på nedenstående (se i øvrigt Kapitel 29: Hjerterehabilitering).
- diætvejledning, rygeophør, motion, vægttab
- blodtrykskontrol til 120-130/70-80 mmHg* (se i øvrigt Kapitel 27: Arteriel hypertension)
- kolesterolsænkende behandling (se i øvrigt Kapitel 28: Dyslipidæmi), diabetes- og blodsukkerkontrol (se i øvrigt Kapitel 26: Diabetes og hjertesygdom)
- fysisk træning
*) Eventuelt tæt på 120 mmHg (alder <80 år) og tæt på 130 mmHg (alder >80 år), hvis det kan opnås uden betydelig polyfarmaci og blodtrykket ikke falder >20 mmHg i stående stilling. Behandlingsmål <120 mmHg systolisk er ikke veldokumenteret.
Influenzavaccination anbefales til alle patienter >65 år med KKS.
Revaskularisering (PCI/CABG)
Den prognostiske gevinst ved revaskularisering af patienter med KKS er mindre udtalt end hos patienter med AKS.
Følgende forhold taler for mulig prognostisk gevinst:
- centrale stenoser (hovedstamme, proksimale LAD), 3-karssygdom med proksimale stenoser og "last remaining vessel"
- større område med dokumenteret reversibel iskæmi ved non-invasiv eller invasiv funktionel test i større kar (FFR≤0,80)
- LVEF ≤35% og større område med reversibel iskæmi
Ved hovedstammestenose, 3-karssygdom eller i øvrigt komplekse læsioner bør forslag til revaskularisering og behandlingstype (PCI eller CABG) drøftes i heartteam, som omfatter både thoraxkirurger og kardiologer.
3.6.2 Symptomatisk behandling
Fraset forholdene beskrevet i Afsnit 3.6.1, retter behandlingen af KKS sig mod symptomlindring. Medicinsk behandling er hjørnestenen i den symptomatiske behandling af KKS. Revaskularisering skal dog overvejes som supplement, da det effektivt kan lindre symptomer, reducere medicinforbruget og forbedre livskvaliteten.
Medicinsk behandling af symptomer
Der sigtes mod at nedsætte hjertets iltforbrug og/eller øge ilttilførslen til hjertet. Dette opnås ved at reducere hjertefrekvensen, afterload, preload og gennem vasodilatation. Yderligere er det vigtigt at korrigere evt. anden årsag til symptomer såsom hypoksi, anæmi og thyroideasygdom.
Blandt nedennævnte farmaka er betablokkere og calciumantagonister 1. valg:
- Betablokkere.
- Calcium-antagonister (dihydropyridinderivaterne f.eks. amlodipin).
- Nitrater; både som hurtigvirkende nitroglycerin p.n. ved angina og situationel forebyggelse og som langtidsvirkende nitrater (CAVE hypertrofisk kardiomyopati og brug af phosphodiesterasehæmmere, f.eks. sildenafil).
- Ivabradin (sinusknudeinhibitor).
- Nicorandil (vasodilatator) – virkningen er omdiskuteret.
Præparaterne kan kombineres og skal tilpasses den enkelte patient. Bedst dokumenteret effekt findes på kombination af betablokker og dihydropyridin calcium-antagonister. Målet er symptomfrihed uden betydende bivirkninger. Man optitrerer til fuld dosis eller maksimalt tolereret dosis uden bivirkninger. Blodtryk, hjertefrekvens og evt. andre bivirkninger skal monitoreres efter ca. 2-4 uger.
Ved samtidigt hjertesvigt er betablokker førstevalg og både ivabradin og langtidsvirkende nitrater kan tillægges, mens calcium-antagonister med negativ inotrop effekt (verapamil og diltiazem) skal undgås. Ivabradin kan anvendes ved sinusrytme og frekvens >60/min.
Med hensyn til ivabradin hos patienter med KKS og bevaret LVEF gives indtil videre kun tilskud efter enkelttilskuds ansøgning, mens der ved samtidig venstre ventrikel dysfunktion ydes klausuleret tilskud.
Revaskularisering (PCI/CABG) - symptomatisk indikation
Revaskularisering erstatter ikke medicinsk behandling, men de to behandlingsformer kombineres ofte for at opnå maksimal symptomlindring.
Såfremt revaskularisering alene forventes at give symptomatisk gevinst, bør patienten initialt være søgt behandlet med medicin. Det skal dog fremhæves, at ønsket om så stor medicinfrihed som muligt for mange patienter er legitimt. Beslutning om revaskularisering eller/og medicinsk behandling skal tages i samråd med patienten og skal inddrage risikoen ved en evt. revaskularisering.
3.7 Særlige forhold
Angina uden obstruktiv sygdom
Typiske anginasymptomer uden tilstedeværelse af obstruktiv sygdom (vurderet invasivt eller non-invasivt) kan skyldes non-obstruktiv/diffus sygdom, sygdom i mikrocirkulationen (mikrovaskulær angina) eller dynamiske stenoser f.eks. koronarspasmer. Den endelige diagnose kan være svær at stille, hvilket ofte er til frustration for patienterne.
Mikrovaskulær angina er ofte associeret med plaque/diffus koronarsygdom (ved invasive eller non-invasive tests). Dokumenteret mikrovaskulær dysfunktion vil ofte være et forstadie til epikardiel sygdom og er associeret med dårlig prognose (bedst dokumenteret hos kvinder). Mikrovaskulær sygdom bør behandles med ACE-hæmmer, statin, livsstilsændringer og vægttab. Angina pectoris behandles med antianginøs medicin (betablokker. calciumantagonist, nicorandil og ivabradin).
Spasmeangina mistænkes, når angina følger døgnrytmen (oftest nat/morgen) og findes især hos yngre rygere. ST-segment forandringer under anfald er et vigtigt diagnostisk redskab, og Holtermonitorering kan være nødvendig for at opnå dokumentation. Størst diagnostisk sikkerhed fås ved provokation med intrakoronar administration af acetylkolin og er en specialistopgave. Medicinsk behandling består af protraheret nitrat og/eller calciumantagonist (betablokkere bør undgås).
Patienter med KKS og samtidig diabetes:
Hos patienter med KKS og samtidig type 2 diabetes anbefales behandling med sodium glucose co-transporter (SGLT)-2 hæmmer eller glucagon-like peptide 1-receptoragonist (GLP-1-RA) som supplement til metformin uafhængigt af HbA1c. Hos patienter med hjertesvigt bør der vælges en SGLT-2-hæmmer. Se Kapitel 26: Diabetes og hjertesygdom.