5. Kronisk hjertesvigt
5.1 Definition og generelt
Hjertesvigt er et syndrom bestående af:
- kardinalsymptomer (dyspnø og væskeophobning), der er kombineret med kliniske tegn (eks. perifere ødemer, krepitation ved lungeauskultation, halsvenestase)
Desuden strukturel eller funktionel nedsættelse af ventriklernes diastole eller systole der resulterer i forhøjet intrakardielt tryk eller nedsat cardiac output i hvile eller under aktivitet
Hjertesvigt har samme høje morbiditet og dødelighed, og samme lave livskvalitet som observeret hos patienter med visse cancerformer. Underbehandling medfører forringet livskvalitet samt forhøjet morbiditet og mortalitet; derfor efterstræbes iværksættelse af dokumenteret behandling, som er vist enten at øge livskvaliteten og/eller reducere dødelighed og indlæggelser for hjertesvigt. Det tilstræbes at give nedenstående guidelinebaseret udredning og behandling (medicinsk behandling, deviceterapi og når tilstanden påkræver det henvisning til højt specialiseret center til udredning mhp. avanceret behandling [transplantation eller mekanisk støtte]).
Behandlingsmålene er yderligere:
- at afdække udløsende årsag til hjertesvigt (punkt 5.2)
- at afdække og håndtere komorbiditet med betydning for patientens hjertesvigt i samarbejde med relevante specialer/almen praksis (punkt 5.5-5.7)
- at facilitere sygdomsindsigt hos patienten mhp. dels at sikre optimal egenomsorg og oplæring i at henvende sig ved signifikant forværring af hjertesvigtsymptomer og fund (punkt 5.5.3 og 5.11)
- at iværksætte genetisk -/familieudredning, hvis relevant (punkt 5.4)
5.2 Ætiologi
- iskæmisk hjertesygdom (hyppigst)
- hypertension
- kardiomyopati
- hjerteklapsygdom
- kongenit hjertesygdom
- andet (f.eks. arytmi, aflejringssygdomme, alkohol, antineoplastika og stråleterapi (se DCS Holdningspapir om kardiologisk håndtering af cancerpatienter) og ukendt)
5.3 Inddeling
- HFrEF (Heart Failure with reduced Ejection Fraction): LVEF: ≤40% - kombineret med kliniske tegn og symptomer på hjertesvigt.
- HFmrEF (Heart Failure with mildly-reduced Ejection Fraction): LVEF: 41-49% - kombineret med kliniske tegn og symptomer på hjertesvigt. Gruppen udgør ca. 10-20% af alle hjertesvigtspatienter. Fænotypisk har HFmrEF mange lighedspunkter med HFrEF. Denne gruppe inkluderer ptt med forbedret LVEF (recovery) fra tidligere LVEF ≤ 40%, og sidstnævnte bør fortsætte allerede iværksat hjertesvigtsbehandling og kan fuldt optitreres trods bedring i LVEF.
- HFpEF (Heart Failure with preserved Ejection Fraction): LVEF: ≥50% - kombineret med kliniske tegn og symptomer på hjertesvigt samt tegn på forhøjet fyldningstryk i venstre ventrikel, eks. forhøjet NT-proBNP (se DCS holdningspapir ”BNP ved hjertesvigt”), venstre ventrikel hypertrofi, og/eller dilateret venstre atrium. Ætiologien og patientgruppen med HFpEF er ofte heterogen og adskiller sig fra HFrEF og HFmrEF.
Den traditionelle inddeling i NYHA funktionsklasse har stadig stor betydning for prognose og behandlingsvalg.
NYHA klassifikation |
NYHA I |
|---|
Ingen fysisk begrænsning. Almindelig fysisk aktivitet medfører ingen dyspnø, træthed eller palpitationer |
NYHA II |
Let begrænsning i fysisk aktivitet. Ingen gener i hvile, men almindelig fysisk aktivitet (trappegang til 2. sal, græsplæneklipning, støvsugning, bære tungere indkøb) medfører nogen dyspnø, træthed og/eller palpitationer |
NYHA III |
Udtalt begrænsning af fysisk aktivitet. Ingen gener i hvile, men lettere fysisk aktivitet (gang på flad vej, af- og påklædning, trappegang til 1. sal) medfører mere udtalte symptomer |
NYHA IV |
Symptomer kan være til stede i hvile og optræder ved enhver form for fysisk aktivitet |
5.4 Udredning
Formålet med udredning er at afklare hjertesvigtsygdommens ætiologi, sværhedsgrad, prognose og planlægge den farmakologiske og non-farmakologiske behandling.
Begrundet mistanke om hjertesvigt baseres på typiske symptomer kombineret med kendt kardiovaskulær sygdom, abnormt EKG (f.eks. atrieflimren, Q-takker, grenblok eller hypertrofi), forhøjet koncentration af NT-proBNP (se DCS holdningspapir ”BNP ved hjertesvigt”) eller risikofaktorer som dysreguleret/flerårig hypertension, kronisk nyreinsufficiens, alkoholoverforbrug, tidligere MI eller diabetes.
Henvisning ved mistænkt hjertesvigt. Ved begrundet mistanke om hjertesvigt, henvises patienten til ekkokardiografi på hospital eller hos praktiserende speciallæge i kardiologi. Henvisningen bør indeholde:
- Anamnese med angivelse af sværhedsgraden af symptomer, funktionspåvirkning (NYHA klasse), objektive fund (eks. vægtøgning), oplysning om tidligere kardiovaskulær sygdom (eks. risiko for iskæmisk hjertesygdom), EKG, thorax-røntgen, lungefunktionsundersøgelse samt blodprøver (hæmoglobin, natrium, kalium og kreatinin, levertal, TSH, HbA1c/glukose og lipidprofil).
- Medicinliste og hvorledes patienten kan kontaktes telefonisk
Udredning på hospital omfatter: klinisk vurdering, ekkokardiografi og udredning af ætiologi. Ved påvisning af hjertesvigt iværksættes behandling og patienterne tilknyttes en hjertesvigtklinik.
Initialt foretages:
- Anamnese med fokus på kardielle og non-kardielle årsager til hjertesvigt, symptomer, ødemer og NYHA-funktionsklasse
- Objektiv undersøgelse.
- EKG tages altid og røntgen af thorax sædvanligvis.
- Ekkokardiografi.
- Laboratorietest med hæmoglobin, leukocytter, trombocytter, elektrolytter, kreatinin, TSH, leverprøver, HBA1c/glukose og lipidprofil. Afhængig af klinik suppleres med urat, karbamid, calcium, magnesium, urinanalyse, jern, transferrin, ferritin og jernmætning (TSAT%). Ved mistanke om kardiomyopatier eller aflejringssygdomme se Kapitel 8: Myokardiesygdomme.
- NT-proBNP anbefales, især i situationer, hvor det kliniske billede er uklart eller pt frembyder konkurrerende lidelser der også kan medføre dyspnø eller ødemer (KOL, brug af Calcium antagonister).
Ekkokardiografi er nøgleundersøgelsen, og påvisning af kardiel dysfunktion i hvile er et diagnostisk kriterium.
- Afklarer ofte patogenesen til hjertesvigt.
- Hjælper til at vurdere sværhedsgraden af hæmodynamisk påvirkning.
- Bør som hovedregel gentages efter, at patienten er fuldt optitreret i ACE-hæmmer/angiotensin-receptor blokker (ARB)/ARNi, betablokker, sodium-glucose cotransporter 2 (SGLT-2) hæmmer og mineralocorticoid receptor-antagonist (MRA), samt hvis der er overvejelser om yderligere terapi (ICD, CRT, ARNi).
- Skal ikke rutinemæssigt gentages, men som hovedregel altid ved uforklarede ændringer i det kliniske billede.
- Kan gentages ved visse ætiologer med formodet reversibel genese (eks. takykardi-induceret hjertesvigt) mhp. at afgøre/planlægge behandlingsstrategien.
Hos patienter med lav-intermediær sandsynlighed for hjertesvigt og NT-proBNP koncentrationer i normalområdet samt normalt EKG, anbefales det at udskyde ekkokardiografi til at andre mere sandsynlige diagnoser er eftersøgt.
NT-proBNP: ved symptomatisk hjertesvigt er NT-proBNP typisk forhøjede ift. køn og alder. Tolkning af NT-proBNP gøres i relation til det samlede kliniske billede, idet eksempelvis atrieflimren og nedsat nyrefunktion giver forhøjede værdier, mens svær adipositas (BMI>35) er associeret til lavere værdier (se DCS holdningspapir om BNP).
Vedrørende prognosevurdering af kroniske hjertesvigtspatienter
- NT-proBNP kan bruges som supplement til risikostratificering af patienter i hjertesvigtsklinikken efter optimalt optitreringsforløb af HFrEF
NT-proBNP anbefales generelt ikke
- til patienter uden symptomer, f.eks. ved helbredsundersøgelser eller screening
- som monitoreringsredskab med gentagne målinger hos hjertesvigtpatienter
- til rutinemæssig og uselekteret brug i akutmodtagelser eller almen praksis
Supplerende undersøgelser har til formål at afklare ætiologi, prognose og comorbiditet/-differentialdiagnostik.
- Iskæmisk hjertesygdom og sværhedsgraden heraf afklares ved hjerte-CT, MR, koronararteriografi eller myokardiescintigrafi (se Kapitel 3: Kronisk koronart syndrom). Patienter med HFrEF og typisk angina pectoris bør som hovedregel udredes for iskæmisk hjertesygdom. Ældre patienter uden angina pectoris vil typisk ikke profitere prognostisk eller symptomatisk af udredning for iskæmisk hjertesygdom, hvorfor man bør være tilbageholdende med dette.
- Holtermonitorering foretages ved mistanke om betydende arytmier.
- Lungefunktionsundersøgelse til afklaring af komorbiditet/differentialdiagnose.
- MR scanning af hjertet anbefales hvis der, efter ekkokardiografi, er usikkerhed om den kardielle funktion, ved mistanke om aflejringssygdomme/sarkoidose og kan overvejes ved kardiomyopati eller ledsagende moderat-svær aortainsufficiens. Anbefales som led i ætiologi-udredningen ved ukendt genese såfremt det har behandlingsmæssig konsekvens.
- DPD-knogleskintigrafi udføres ved mistanke om transthyretin kardiel amyloidose (se Kapitel 8: Myokardiesygdomme).
- Højresidig hjertekaterisation og myokardiebiopsi udføres sædvanligvis kun hos mulige transplantationskandidater, eller hvis andre undersøgelser har givet mistanke om aflejringssygdom/infiltrativ sygdom i myokardiet samt differentialdiagnostisk eksempelvis ved mistanke om myokarditis. Højresidig hjertekateterisation kan være indiceret hos udvalgte højsymptomatiske patienter med mistanke om HFpEF, hvor non-invasive undersøgelser ikke har kunne afklare diagnosen.
- Genetisk -/familieudredning ved familiære tilfælde af dilateret kardiomyopati, pludselig død eller familiær hyperkolesterolæmi (se Kapitel 32: Arvelige hjertesygdomme). Udredning bør overvejes ved fravær af en oplagt udløsende årsag (f.eks. iskæmisk hjertesygdom, hypertension, klapsygdom, takykardi o.a.), såfremt symptomdebut for patienten er ≤60 år. Genetisk udredning bør foretages af specialister indenfor arvelige hjertesygdomme, da der kan være forhold (f.eks. alder, etiske og forsikringsmæssige forhold), der gør at genetisk testning ikke nødvendigvis skal udføres på alle med non-iskæmisk kardiomyopati.
5.5 Behandling
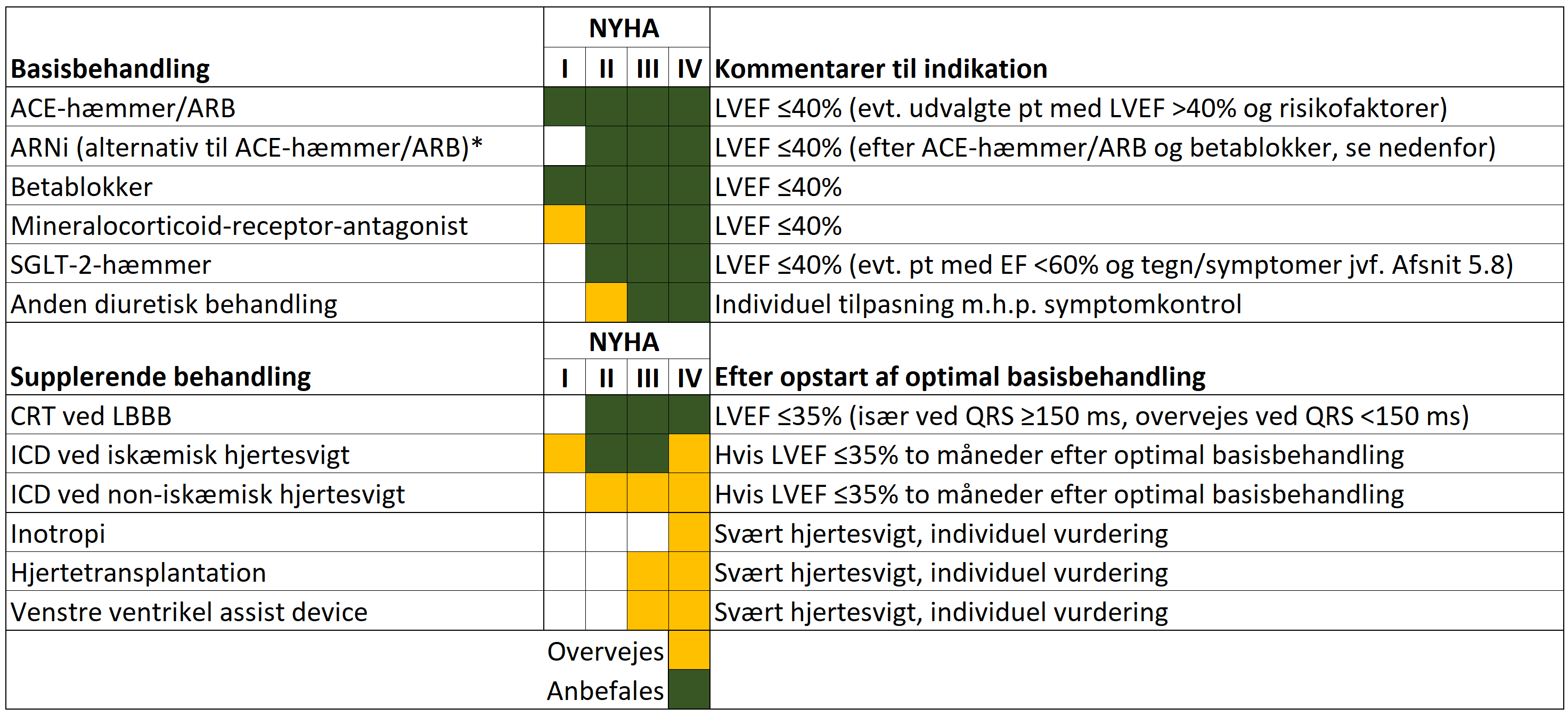
Målet for behandlingen af hjertesvigtspatienter er at reducere morbiditet, mortalitet og symptomer. Specifik behandling mod den udløsende årsag til hjertesvigt bør altid tilstræbes. Nedenstående behandling tilstræbes givet til alle patienter med HFrEF.
Basisbehandlingen ved HFrEF består af ACE-hæmmer/ARB/ARNi, betablokker, SGLT-2 hæmmer og MRA, der alle har en dokumenteret livsforlængende og morbiditetsreducerende effekt hos patienter med HFrEF (Tabel 5.1). Alle præparater forsøges givet i lave doser hurtigst muligt (< 4 uger). Det er ofte muligt at give 2 præparater samtidigt. Maximale tolerable doser søges opnået så hurtigt som muligt, typisk inden for 2-3 måneder.
Hvis dette ikke er muligt, f.eks. pga. bivirkninger, compliance, frailty, komorbiditet, bør behandlingsmål diskuteres med kardiolog med erfaring indenfor hjertesvigt. Nedenstående Tabel 5.1 giver en oversigt af behandlingen.
En opnået medicinsk behandling for kronisk HFrEF søges fastholdt og skal ikke reduceres eller seponeres, med mindre der er svære bivirkninger. Hypotension alene bør ikke medføre reduktion/seponering medmindre patienten er udtalt symptomatisk.
5.5.1 Farmakologisk behandling af HFrEF
ACE-hæmmere og Angiotensin II receptor blokker (ARB)
ACE-hæmmere er basisbehandling for patienter med HFrEF og forbedrer overlevelsen uden at ændre nævneværdigt på symptomerne.
- Patienter, der ikke i forvejen får ACE-hæmmer eller ARB, opstartes med ACE-hæmmer.
- Behandlingen startes i lav dosis. Halv dosis af startdosis gives ved ortostatisk svimmelhed, systolisk blodtryk <100 mmHg, eGFR <30 ml/min og ved intensiv diuretisk behandling.
- Første dosis kan med fordel gives om aftenen.
- Der optitreres til doser anvendt i de kliniske studier. Dosis fordobles med 1-2 ugers intervaller, dog dagligt under indlæggelse ved monitorering af nyrefunktion og blodtryk.
- Kreatinin og kalium måles før behandlingsstart, efter 1 og 4 uger og derefter efter skøn.
- En relativ stigning i kreatinin på 30% er forventelig, mens større stigninger (>50%) altid bør medføre afklaring af årsagen og eventuelt ophør eller dosisreduktion.
ACE-hæmning betragtes som en klasseeffekt, og alle ACE-hæmmere kan anvendes. Den bedste dokumentation for mortalitetsreduktion findes dog for enalapril, ramipril og trandalopril. Se Tabel 5.2
ARB gives til patienter, som under ACE-hæmmer behandling udvikler persisterende tør hoste uden anden forklaring (inkompensation) eller anden uacceptabel bivirkning.
- der optitreres til de angivne måldoser, som har mortalitets- og morbiditetsreducerende virkning eller til maksimalt tålte doser
- ARB giver samme grad af nyrefunktionspåvirkning som ACE-hæmmere
- behandlingen gives efter samme forholdsregler som for ACE-hæmmere
Tabel 5.3: Start- og måldoser for ARB markedsført i Danmark med indikationen HFrEF | ||
| Startdosis | Måldosis |
|---|---|---|
Candesartan | 4 mg x 1 | 32 mg x 1 |
Valsartan | 40 mg x 2 | 160 mg x 2 |
Losartan | 25 mg x 1 | 150 mg x 1 |
Angiotensin Receptor og Neprilysin Inhibitor (ARNi)
ARNi består af en ARB (valsartan) og en neprilysin inhibitor (sacubitril) i samme pille. Måldosis for sacubitril/valsartan er 97/103 mg x 2.
ARNi er indiceret til HFrEF patienter når følgende kriterier er opfyldt:
- Patienten forsøges rutinemæssigt optitreret til fuldt tolerable doser af ACE-hæmmer/ARB, MRA, SGLT-2i og betablokker. Men ARNi kan være førstevalg (uden optitrering af ACE- hæmmer/ARB behandling) til udvalgte patienter, som med meget stor sandsynlighed bliver ved med at have lav LVEF. Det vil typisk være patienter uden potentielt reversibel årsag (reversible årsager kan f.eks. være LBBB, hypertension, pacemaker-induceret, atrieflimren med potentielt takykardi-induceret HF), og hvor der skønnes at være betydelig prognostisk gevinst ved at skifte til ARNi.
- Første dosis kan med fordel gives om aftenen.
- Fortsatte symptomer på hjertesvigt (NYHA II-IV). Hvis man er i tvivl om symptomer skyldes hjertesvigt, særligt ved NYHA I - II, bør indikationen understøttes af en forhøjet NT-proBNP eller en ny ekkokardiografi.
- Systolisk blodtryk ≥95 mmHg.
Følgende forholdsregler iagttages ved opstart af ARNi:
- Behandlingen startes efter konference med speciallæge i kardiologi.
- Anbefales generelt ikke til patienter med eGFR <30 ml/min.
- Behandlingen monitoreres som ved ACE-hæmmer, dvs. med blodtryk, symptomer på svimmelhed og angioødem. Nyrefunktion kontrolleres efter et par uger.
- ACE-hæmmer seponeres 36 timer før start af ARNi. Ikke nødvendigt ved ARB behandling.
- Patienter, der forinden fik maksimal ACE-hæmmer/ARB dosis, kan starte sacubitril/valsartan (49/51 mg) x 2 og optitreres efter 1-2 uger.
- Patienter, der forinden fik lav dosis ACE-hæmmer/ARB dosis, starter med sacubitril/valsartan (24/26 mg) x 2, og der optitreres efter 3-4 uger.
- Patienter med kronisk hjertesvigt, der indlægges med forværring af hjertesvigt trods optimal behandling, kan overvejes skiftet til ARNi fra ACE- hæmmer/ARB under samme indlæggelse under hensyntagen til ovenstående forholdsregler.
Betablokkere
Gives til alle, som har eller har haft HFrEF, og forbedrer overlevelsen.
- I Danmark bruges carvedilol, metoprolol succinat, bisoprolol og nebivolol. De tre førstnævnte har vist mortalitetsreduktion i kliniske studier.
- Ved opstart kan patienterne opleve en midlertidig forværring af symptomer i op til flere uger, hvilket de bør informeres om.
- Bør først startes, når patienten er afvandet og i klinisk stabil fase.
- Der bør udvises forsigtighed med opstart af betablokkere hos patienter med lav LVEF og tegn på kompensatorisk takykardi.
- Kronisk obstruktiv lungesygdom uden reversibel luftvejsobstruktion og perifer arteriel insufficiens kontraindicerer ikke initiering af betablokade. Ved svær astma skal man overveje at drøfte behandlingen med lungemedicinsk læge, alternativt forsøge med ivabradin (ved sinusrytme).
- Der opstartes i lav dosis og øges (fordobles) i dosis efter 2 uger, indtil måldosis eller maksimal opnåelig dosis er nået.
- Hos patienter med betydeligt symptomatisk hjertesvigt (NYHA III-IV) bør optitrering foregå langsommere og under tæt kontrol af blodtryk og puls.
- Undertiden kan indlæggelse under optitrering være nødvendig.
- Ved atrieflimren med hurtig frekvens prioriteres tidlig opstart af betablokade. Subgruppeanalyser af randomiserede studier antyder, at der ved atrieflimren kan være mindre gavn af at optitrere betablokker til fuld dosis. Den optimale hjertefrekvens ved atrieflimren og hjertesvigt kendes ikke, men er formentlig mellem 60 og 100 slag/min.
Diuretika
Gives til alle med tegn på væskeretention.
- Ved normal nyrefunktion startes i lave doser eksempelvis furosemid tbl. 40 mg x 2-3, bumetanid tbl. 1 mg x 2-3 eller ved beskedne symptomer tbl. bendroflumethiazid 2,5 mg x 1-2.
- Lav dosis loop diuretika (f.eks. <40 mg furosemid) og retard præparater kan doseres én gang i døgnet ellers fordeles dosis på 2-3 administrationer, særligt bumetanid der har kort halveringstid.
- Ved behov for større mængde loop-diuretikum kan kombination med et thiaziddiuretikum- øge effekten.
- Peroral furosemid absorberes bedst ved indtagelse en halv time før eller 2 timer efter et måltid og pt bør informeres herom ved opstart og understreges ved uforklaret fortsat vægtøgning trods stigende doser diuretika, når compliance er sikret. Biotilgængeligheden ved peroral behandling med loop-diuretika er hhv. ca. 50-60% for furosemid og ca. 80-95% for bumetanid.
- Metolazone er et potent thiazidlignende diuretikum der har effekt ved lavere eGFR end andre thiazider (tilladelsespræparat). Kan anvendes i kombination med loop diuretika ved behandlingsrefraktær inkompensation.1,25-5 mg x 1. Der er risiko for elektrolytforstyrrelser, hvorfor der kræves monitorering af væsketal.
- Klassiske thiazider er ikke effektive ved svært nedsat nyrefunktion (eGFR <30 ml/min).
- Loop diuretika reduceres i takt med den symptomlindring, der ofte ses ved CRT- og baggrundsbehandling.
Mineralocorticoid-receptor-antagonister (MRA)
Behandling med MRA anbefales rutinemæssigt ved symptomatisk hjertesvigt (NYHA II-IV) og LVEF ≤ 40% for at øge overlevelsen. Spironolakton og eplerenon kan begge bruges som førstevalg. I Danmark afvikles et clusterrandomiseret klinisk studie, hvor afdelinger allokeres til at opstarte spironolakton eller eplerenon til patienter med nydiagnosticeret hjertesvigt. Patienter, der ikke tåler spironolakton på grund af bivirkninger (gynækomasti eller smerter i mammae) bør have eplerenon.
MRA bør generelt ikke anvendes til patienter med nyreinsufficiens (s-kreatinin >220 mikromol/l, eGFR <30 ml/min eller Kalium >5,0 mmol/l).
- Startdosis er 12,5 (spiron)- 25 mg (begge præparater) x 1 stigende til 25-50 mg x 1 under kontrol af Kalium og nyrefunktion. Peroral kaliumtilskud overvejes reduceret/seponeret ved opstart af MRA.
- Behandlingen bør påbegyndes på lige fod med anden basisbehandling (se tabel 1), men kræver nøje monitorering af blodtryk og nyrefunktion.
- Na+, K+ og kreatinin bør kontrolleres første gang senest en uge efter behandlingsstart, særligt ved nedsat nyrefunktion, og for patienter i stabil fase mindst hver 3.-6. måned.
- Skal pauseres/reduceres i forbindelse med episoder med dehydrering, stigende kreatinin, eller Kalium over 5,5 mmol/l. Skal seponeres ved vedvarende Kalium over 6,0 mmol/l.
SGLT-2-hæmmer
Hæmmere af sodium-glucose cotransporter 2 (SGLT-2 hæmmer) anbefales ved symptomatisk HFrEF. Effekten er mindre ved EF >40%, men kan gives til udvalgte patienter med tegn/ udtalte symptomer på HFmrEF og HFpEF.
Behandlingen er generelt indiceret til hjertesvigtspatienter med type 2 diabetes eller nedsat nyrefunktion og kan opstartes i primærsektoren såfremt en af de to komorbiditeter er tilstede. For andre patienter bør følgende kriterier være opfyldt:
- kronisk HFrEF med LVEF ≤40% (eller patienter med LVEF <60% med tegn/symptomer jvf punkt 5.1 og 5.3)
- symptomer der skyldes hjertesvigt (NYHA II-IV)
- systolisk BT ≥95 mmHg
- eGFR ≥20 ml/min
Ved kronisk HFrEF og behandling med SGLT-2 hæmmer iagttages følgende:
- Brug en SGLT-2 hæmmer, der er godkendt til behandling af hjertesvigt (empagliflozin og dapagliflozin). Præparaterne anses for at være ligeværdige
- SGLT-2 hæmmer bør startes tidligt i forløbet (med fordel under indlæggelsen), og inden patienten er i maksimale doser af øvrige basispræparater (Tabel 5.1).
- Ved opstart på SGLT-2 hæmmer behandling kan man forvente et fald i eGFR hos ca. 30% (”Dippers”). Faldet er reversibelt og bør ikke medføre reduktion/seponering af SGLT-2 hæmmer eller anden medicin.
- Diuretikadosis kan overvejes reduceret, og kontrol af hydreringsgrad bør overvejes efter 2-4 ugers behandling.
- Vær opmærksom på at ketoacidose kan forekomme i relation til SGLT-2 hæmmer behandling ved anden akut svær sygdom inklusiv elektiv kirurgi og indlæggelseskrævende infektion. Overvej da at pausere behandlingen.
- Gives ikke til patienter med Type-1-diabetes.
- Ved mere kompliceret diabetesbehandling konfereres med endokrinolog, særligt hvis patienten er i insulin eller sulfonylurinstof behandling pga. risiko for betydende hypoglykæmi. Ved ukompliceret diabetes forekommer hypoglykæmi sjældent.
Ivabradin
Overvejes til patienter i sinusrytme med fortsatte symptomer (NYHA II-IV) efter optitrering med ACE-hæmmer/ARB/ARNi, betablokker, MRA og SGLT2 hæmmer, hvor EF stadig er ≤35%, og hjertefrekvens er > 70 slag/min målt efter 5 min hvile. Der er ikke dokumenteret overlevelsesgevinst ved anvendelse af Ivabradin, men behandlingen kan reducere risikoen for indlæggelse for hjertesvigt.
- Betablokkerbehandling skal være forsøgt maksimalt optitreret inden opstart. Ivabradin kan dog forsøges, hvis patienten har uacceptable bivirkninger til flere typer af betablokkere.
- Anden årsag til sinustakykardi skal overvejes inden opstart – f.eks. inkompensation, thyrotoksikose, hypovolæmi, infektion og/eller anæmi.
- Initialt doseres 5 mg x 2 (2,5 mg x 2 ved ældre > 75 år), stigende til 7,5 mg x 2 afhængig af effekt. Effekten er større jo højere initial hjertefrekvens.
Digoxin
Anvendes ikke rutinemæssigt men til patienter med atrieflimren og til udvalgte patienter i sinusrytme med uacceptable symptomer på trods af behandling med ovennævnte farmaka. Der er ikke dokumenteret overlevelsesgevinst ved anvendelse af digoxin, men behandlingen kan reducere indlæggelse for hjertesvigt og er således rent symptomatisk. Det foretrækkes at dosere til laveste del af terapeutisk interval. Man bør være opmærksom på den mulige synergistiske effekt mellem digoxin og anden frekvensregulerende behandling.
Supplerende farmakologisk terapi til overvejelse ved HFrEF
- Hydralazin + isosorbiddinitrat. Udvalgte patienter med HFrEF kan behandles med kombinationen Apresolin® og Cardopax Retard® (protraheret nitrat) for at øge overlevelsen. Det gælder patienter, hvor ACE-hæmmer/ARB/ARNi har været forsøgt, men ikke tolereres, f.eks. patienter med nedsat nyrefunktion. Initialt anbefales Apresolin® 25 mg x 2 dagligt, stigende til 75 mg x 3, men doser over 100 mg dagligt er forbundet med flere bivirkninger. Apresolin® (tilladelsespræparat) kræver ”human generel udleveringstilladelse”, som søges via lægemiddelstyrelsen. Cardopax Retard® gives initialt 40 + 20 mg dagligt stigende til 80 mg kl. 8 og 40 mg kl. 18. I øjeblikket gennemføres det danske placebokontrollerede DanHeart studie med apresolin og isosorbiddinitrat versus placebo som add-on terapi til patienter med HFrEF.
- Såfremt hydralazin + isosorbiddinitrat er opstartet på baggrund af nyrepåvirkning, bør der skiftes til RAAS blokade/ARNi hvis nyrefunktionen bedres.
- Intravenøs jern anbefales ikke rutinemæssigt pga. manglende dokumentation for en mortalitetsgevinst. Imidlertid kan i.v. jern overvejes som symptomatisk behandling ved jernmangel (ferritin under 100 mikrogram/l eller ferritin 100-300 mikrogram/l i kombination med transferrin mætning <20%).
- Q10 har i et enkelt mindre studie vist sig at have positive effekter på mortalitet som var et sekundært endepunkt, men indtil yderligere studier foreligger anbefales det ikke rutinemæssigt.
- Vericiguat kan overvejes hos udvalgte hjertesvigtspatienter, såfremt basisbehandlingen er optimeret og patienten ikke er kandidat til avanceret behandling. Behandlingen må anses at være en specialistopgave.
Inotropi
Ved akut forværring og terapiresistent væskeretention - til trods for i.v. loop diuretika eventuelt i kombination med thiazider - kan inotropi overvejes. Bør kun opstartes, hvis det skønnes at forværring af hjertesvigt er reversibelt, eller at behandlingen følges af mekanisk cirkulationsstøtte eller transplantation (se Kapitel 4: Akut hjertesvigt). Levosimendan kan overvejes til udvalgte patienter med refraktært svært hjertesvigt, lavt blodtryk, nedsat cardiac output og overhydrering, ved ønske om kortvarig positiv effekt på nyrefunktion og hæmodynamik. Sådanne patienter bør konfereres med center hvis det vurderes at der er mulighed for mere avanceret behandling (eks. LVAD/HTx).
5.5.2 Pacemaker og ICD behandling ved HFrEF
Biventrikulær pacing/ Cardiac Resynchronization Therapy (CRT)
Formålet med behandlingen er at resynkronisere kontraktionen af venstre ventrikel ved konventionel endokardial pacing af højre ventrikel og pacing af venstre ventrikel via en paceelektrode indført i en sidegren til sinus coronarius. Til de rette patienter kan CRT forbedre arbejdskapaciteten, reducere hjertesvigtssymptomer, hospitalsindlæggelser og mortalitet. Behandlingen kan kombineres med en ICD afhængig af alder, komorbiditet og hjertesvigtsgenese (CRT-D) (se Kapitel 20: Implanterbar defibrillator (ICD)).
Følgende patienter bør derfor henvises til vurdering af, om der er indikation for CRT:
- hjertesvigtssymptomer svarende til NYHA II-IV trods optimal medicinsk behandling, hvilket bør indbefatte ARNi såfremt patienten tolererer dette (NYHA IV: fortrinsvis ambulante, ikke-hospitaliserede patienter), og
- EF ≤35% (ved en nylig ekkokardiografi) og
- venstresidigt grenblok med QRS ≥130 ms
- patienter med symptomatisk hjertesvigt og aftagende LVEF til <40% under høj andel af RV pacing på eksisterende device
CRT bør som regel tilbydes patienter med QRS >150 ms. Indikationen for CRT hos patienter med LBBB QRS 130-150 ms bør kun stilles efter individuel vurdering baseret på NYHA klasse, hjertesvigts ætiologi, køn, og arvæv (se Kapitel 19: Pacemakerbehandling).
Ved permanent atrieflimren skal patienten være tilstrækkeligt frekvensreguleret for at profitere af behandlingen (>90% BiV-pace), og såfremt dette ikke opnås farmakologisk, må man overveje His-ablation.
Overvejelser om CRT ved følgende kliniske situationer/problemstillinger:
- Ved indikation/behov for bradypacing, hos patienter med symptomatisk hjertesvigt og LVEF ≤40%, hvor der i en betydelig andel af tiden forventes pacing i højre ventrikel, bør der tilbydes CRT.
- bør overvejes tidligt i forløbet ved symptomatisk HFrEF og begrænset mulighed for optitrering grundet hypotension og/eller svære bivirkninger, ovenstående såfremt ekkokardiografiske og EKG- kriterier er opfyldt
- Ved ikke-venstresidigt grenblok er behandlingsgevinsten mere tvivlsom. Efter individuel vurdering kan CRT overvejes ved NYHA III-IV, LVEF ≤35% og QRS >150 ms. Man kan basere indikationen på tilstedeværelse af mekanisk dyssynkroni af venstre ventrikel påvist ved en billeddannende modalitet (oftest ekkokardiografi) og i tæt samarbejde med det implanterende center.
- En opgradering til en CRT enhed er ofte en mere kompleks procedure, der er forbundet med en øget risiko for komplikationer.
Ved manglende symptomatisk bedring eller forværring efter, at patienten initialt har responderet godt på CRT, bør man konferere med det implanterende center med henblik på reversibel årsag: f.eks. manglende capture sv.t. sinus coronarius elektroden, hyppige episoder med takyarytmi eller sub-optimal programmering.
Implanterbar defibrillator (ICD)
Primær profylaktisk ICD er generelt indiceret, hvis der trods optimal medicinsk behandling fortsat er
- symptomer NYHA-klasse II-III og
- LVEF ≤35% og
- iskæmisk betinget hjertesvigt
Patienter med HFrEF skal være mindst 3 måneder på afstand af AMI, CABG, optimal medicinsk behandling samt en individuel vurdering efter PCI, dog kan der fraviges fra tidskravet, hvis patienten har betydende ventrikulære arytmi eller uforklarede synkoper.
Ved non-iskæmisk hjertesvigt anbefales primær profylaktisk implantation hos yngre patienter, selvom en egentlig aldersgrænse ikke kan fastsættes. Det må bero på en individuel vurdering af patienten, og DANISH-resultatet indikerer at patientgruppen ældre end 70 år ikke har gevinst af primær profylaktisk ICD. Forekomst af arvelig kardiomyopati og herunder familieanamnese med VT/pludselig hjertedød, og mulige specifikke mutationer med øget risiko for pludselig hjertedød, bør indgå i overvejelserne hos de yngre.
Patienten henvises til center mhp. stillingtagen til ICD-implantation. Ved svært symptomatiske patienter (NYHA IV) er der ikke indikation for primær profylaktisk ICD, medmindre patienten er kandidat til CRT, venstre ventrikel assist device (LVAD) eller hjertetransplantation (HTx). Der foreligger dog ikke evidens der nødvendigvis anbefaler ICD forud for eller efter LVAD implantation.
CRT og ICD-behandling skal generelt ikke tilbydes patienter med forventet begrænset restlevetid (<12 måneder), betydende komorbiditet, fremskreden biologisk alder eller psykiske faktorer, der kan vanskeliggøre accept af behandlingen.
Sekundær profylaktisk ICD tilbydes efter vanlige retningslinjer (se Kapitel 20: Implanterbar defibrillator (ICD)).
5.5.3 Non-farmakologisk behandling
Opfølgning bør foregå i hjertesvigtklinik med personale, der er uddannet til at følge disse patienter. Nedenstående behandlinger har ikke tilstrækkelig dokumenteret effekt på overlevelsen, men kan forbedre symptomer, livskvalitet, sygdomsforståelse og er dermed relevant at overveje for udvalgte patienter.
- Fysisk træning anbefales til patienter med milde til moderate hjertesvigtsymptomer. Patienter skal være velkompenserede, stabile og i et optitreringsforløb, men ikke nødvendigvis fuldt optitreret i alle præparater. Træningen giver bedre fysisk formåen og bedre livskvalitet, men er uden sikker effekt på overlevelsen.
- Patienter med tendens til overhydrering bør nedsætte væskeindtaget til <2 l/døgn, der bør drøftes compliance samt tidspunkt for indtag af diuretika. Tilsvarende bør saltindtag reduceres.
- Optitrering af den medicinske behandling og monitorering kan evt. foregå ved hjælp af telemedicinske løsninger (se rapport fra Sundhedsstyrelsen om Telemedicin til mennesker med hjertesvigt, sept 2020)
- Diæt er en naturlig del af behandlingen hos overvægtige patienter med hjertesvigt, men der er aldrig påvist reduktion af morbiditet eller mortalitet ved vægttab. Hos patienter med kardiel kakeksi eller underernæring bør kosten sigte mod at undgå yderligere vægttab.
- Søvnapnø optræder hos op mod en tredjedel af patienter med hjertesvigt, hyppigere ved NYHA III og IV. Patienter i NYHA klasse III-IV har overvejende central søvnapnø, hvor behandling med adaptiv servo-ventilation frarådes pga. overdødelighed i et stort randomiseret studie.
5.5.4 Behandling af iskæmisk hjertesygdom
Patienter med iskæmisk hjertesygdom og HFrEF, som ikke får statin, skal ikke rutinemæssigt tilbydes denne behandling.
CABG er indiceret hos patienter med LVEF ≤35% med angina pectoris, betydende koronarsygdom i form af hovedstammestenose eller hovedstammestenoseækvivalent samt proksimal LAD-stenose med 2- eller 3-karssygdom. Revaskularisering hos patienter med HFrEF uden angina pectoris er kontroversielt (se kapitel 3: Kronisk koronart syndrom).
5.6 Medicin som skal undgås ved hjertesvigt
NSAID og COX-2 hæmmere reducerer nyrefunktionen og medfører salt- og vandretention hos hjertesvigtpatienter. De bør helt undgås, da de formentlig øger mortaliteten. Smerter behandles med paracetamol eller opioid præparater.
Calciumantagonister af non-dihydropyridintype (verapamil, diltiazem) virker negativt inotrope og medfører forværring i hjertesvigt. Dihydropyridiner (amlodipin, felodipin) kan anvendes til evt. behandling af hypertension eller angina pectoris, men er ikke indiceret for HFrEF per se.
Antiarytmika skal anvendes med forsigtighed. Dronedarone og Klasse IC præparater (eks Flecainid) er kontraindicerede for patienter med hjertesvigt eller LVEF <40%. Hvis der er behov for behandling med et klasse III antiarytmikum, bør amiodaron foretrækkes.
5.7 Hyppige problemstillinger ved kronisk hjertesvigt
Non-sustained ventrikulær takykardi (NSVT) er et overordentligt hyppigt fund hos patienter med HFrEF. Farmakologisk behandling af asymptomatisk NSVT, udover betablokade og korrektion af evt. hypokaliæmi, er ikke indiceret.
LVEF remission: Nogle patienter vil opleve (nær-) normalisering af deres LVEF. Dette skyldes oftest god medicinsk behandling, mens nogle kardiomyopatier (eks. alkoholisk kardiomyopati, Takutsubo kardiomyopati), har en høj remissionsrate. På trods af dette skal hjertesvigtsbehandling anses for at være livslang.
Atrieflimren optræder hos ca. 20% af patienter med kronisk hjertesvigt, men hyppigere ved akut indlæggelse. I udgangspunktet gives optimal hjertesvigtsbehandling som beskrevet (se punkt 5.5.1). Der bør tilstræbes en middelfrekvens på < 110 hos patienter med atrieflimren. Rytmekontrollerende strategi i form af kateterablation bør tilbydes yngre patienter med hjertesvigt, og tilbagevendende symptomatisk AFLI under optimal antikongestiv behandling, hvor symptomlindring er den afgørende behandlingsgevinst. Ved rytmekontrollerende strategi for patienter med persisterende AFLI, bør der påvises symptombedring og/eller betydende forbedring af LVEF ved opnåelse af sinusrytme med DC-konvertering og/eller amiodaron.
Hypotension er primært et problem, hvis den er symptomatisk. Doseringen af ACE-hæmmer/ARB eller betablokker bør kun reduceres/seponeres efter at anden blodtrykssænkende behandling er søgt justeret. Ortostatisk hypotension er en naturlig konsekvens af den givne behandling og bør kun sjældent medføre behandlingsændring.
Kaliumforstyrrelser. Hyperkaliæmi optræder hyppigt i forbindelse med ACE-hæmmer/ARB og især ved kombination med MRA. Kun repetitive kalium koncentrationer >5.5 mmol/L bør medføre dosisreduktion. Hvis det ikke løses ved at reducere eller fjerne kaliumtilskud, kan MRA reduceres i dosis (evt kun midlertidigt), men somme tider må behandlingen med MRA afbrydes (se punkt 5.5.1).
Det tilstræbes at undgå hypokaliæmi, som er associeret med arytmi og øget mortalitet i observationelle studier.
Kronisk hyponatriæmi behandles med væskerestriktion.
Stigende kreatinin skyldes ofte dehydrering på grund af kraftig diuretisk behandling eller hypotension. Behandlingen med ACE-hæmmer/ARB/ARNi og SGLT2-hæmmer er dokumenteret renoprotektiv og bør udelukkende seponeres på tvingende indikation.
Tør hoste skyldes oftest enten ACE-hæmmer behandling eller inkompensation. Prøv evt. at øge diuretikadosis og evaluér inden der skiftes til ARB/ARNi. Såfremt hosten persisterer under ARB skiftes tilbage, og årsagen til hosten afsøges.
Arthritis urica er enten en konsekvens af sygdommen eller af den diuretiske behandling. Behandles med intraartikulære steroid injektioner, paracetamol eller colchicin i det akutte stadie. Profylaktisk behandling med allopurinol efter vanlige retningslinier (CAVE: nyrefunktion).
Erektil dysfunktion er enten en følge af sygdommen eller behandlingen heraf. Overvej skifte fra spironolacton til eplerenon, og skifte af betablokker til Nebivolol. Patienter kan tilbydes behandling med PDE-5-hæmmere efter vanlige retningslinier.
Depression forekommer hos 10-20% af patienter med hjertesvigt og er associeret med værre NYHA klasse, compliance og prognose. Vanlig behandling med antidepressiva har ikke vist overbevisende effekt på symptomer hos patienter med hjertesvigt.
5.8 Farmakologisk behandling af HFpEF og HFmrEF
Hos patienter med symptomer på hjertesvigt og venstre ventrikel LVEF >40% er behandlingen især rettet mod den objektivt påviselige dysfunktion eksempelvis atrieflimren, hjerteklapfejl, iskæmisk hjertesygdom, hypertension og evt. højresidig hjertesvigt. En del patienter har tidligere haft HFrEF, og disse fortsætter behandling som ved HFrEF.
Behandling med hjertesvigtsmedicin af de novo hjertesvigt med LVEF >40% og symptomer kan igangsættes. Mange patienter har en anden indikation for ACE- hæmmer/ARB, betablokker eller SGLT-2 hæmmer behandling pga. hypertension, diabetes, nyresygdom, atrieflimren,
Patienter med HFmrEF (LVEF: 41-49%) er i en gråzone, hvad angår dokumenteret farmakologisk behandling. Der har i flere studier ikke kunne påvises morbiditets- eller mortalitetsreducerende virkning af ACE-hæmmer/ ARB eller betablokker, men SGLT-2-hæmmer og MRA kan overvejes, selv om den absolutte effekt er mindre end ved HFrEF. SGLT-2 hæmmere godkendt til hjertesvigt bør derfor overvejes til patienter, med symptomatisk hjertesvigt der opfylder kriterierne i punkt 5.3.
Mange patienter med HFpEF (LVEF: ≥50%) er overhydreret og kan få symptomatisk gevinst af diuretisk behandling. Desuden kan man opstarte SGLT-2 hæmmer (godkendt til HFpEF) til HFpEF patienter der har været indlagt for inkompensation for at nedsætte risikoen for fremtidige hjertesvigtsindlæggelser.
5.9 Farmakologisk behandling af højresidig hjertesvigt
Kronisk højresidig hjertesvigt forekommer oftest sekundært til kronisk venstresidig hjertesvigt. Isoleret kronisk højre ventrikelsvigt kan b.la. optræde på grund af tidligere højre ventrikel infarkt, lungeemboli, pulmonal hypertension, tricuspidal- og pulmonalklap-lidelser, kongenit hjertesygdom, venstre-højre shunt og perikardielidelser.
Specifik behandling af en række af de ovennævnte lidelser er omtalt i kapitel om akut højresidig hjertesvigt (se Kapitel 4: Akut hjertesvigt) og pulmonal hypertension (se Kapitel 13: Pulmonal hypertension). Ved overvejelser om afterloadreduktion med pulmonal vasodilatation, pacemakermedieret hjertefrekvensøgning og transplantation/assist device henvises til center.
Det er vigtigt at udrede årsagen til tilstanden med henblik på kausal behandling. Udredning kan ud over ekkokardiografi omfatte bla. koronararteriografi, MR, højresidig hjertekateterisation, lungefunktionsundersøgelse, lungescintigrafi og CT-scanning af thorax.
Der foreligger ingen større, randomiserede undersøgelser vedrørende medicinsk behandling af isoleret højre ventrikel svigt. ACE-hæmmer/ARB og spironolacton er uden dokumenteret effekt (med mindre der også optræder venstre ventrikelsvigt). Betablokkerbehandling opfattes som relativt kontraindiceret, med mindre der foreligger venstre ventrikelsvigt.
5.10 Svært hjertesvigt – advanced heart failure
Ca. 10% af patienterne med hjertesvigt progredierer til fremskredne stadier (NYHA III-IV), trods optimal behandling. Disse patienter har en 1-års mortalitetsrisiko på omkring 25-50% og bør konfereres med center, når patienterne opfylder følgende kriterier:
- Vedvarende symptomer på hjertesvigt (NYHA klasse III (vedvarende) eller IV), trods forsøg på optimal medicinsk behandling inkl. evt. device.
- Svær kardiel dysfunktion trods forsøg på optimal medicinsk behandling inkl. evt. device (f.eks. LVEF ≤30%, isoleret svær LV diastolisk svigt, RV-svigt, ikke-operabel svær klapsygdom).
- Lavt systolisk blodtryk (<90 mmHg), tiltagende nefropati, og/eller intolerance for ACE-hæmmer og betablokker.
- Gentagne episoder med inkompensation eller lavt blodtryk, krævende højdosis intravenøs diuretika, eller behov for inotropistøtte og >1 indlæggelse i de sidste 12 måneder.
- Gentagne adekvate stød fra ICD eller ventrikulære arytmier i betydeligt omfang.
Patienter der potentielt kan være kandidat til hjertetransplantation eller LVAD bør vurderes 1-2 gange årligt på ovenstående parametre og henvises til center ved progression.
5.10.1 Hjertetransplantation og venstre ventrikel assist device
Der foretages 25-30 hjertetransplantationer årligt i Danmark. Hjertetransplantation (HTx) bør overvejes hos patienter med symptomer svarende til NYHA klasse III-IV trods optimal medicinsk behandling og implantation af biventrikulær pacemaker (hvis indiceret).
- Der findes ingen principiel øvre aldersgrænse, men i praksis vil de fleste patienter over 70 år have betydende kontraindikationer.
- I enkeltstående tilfælde kan hjertetransplantation komme på tale hos patienter uden fremtrædende hjertesvigt, eksempelvis ved isolerede kardiale tumorer eller behandlingsrefraktære ventrikulære arytmier.
- Patienter, som ikke kan tilbydes hjertetransplantation, eksempelvis på grund af nylig cancer eller forhøjet lungekarmodstand, kan eventuelt tilbydes implantation af LVAD som destinationsbehandling, bro til transplantation eller bro til endelig beslutning.
- Patienterne henvises fra regionernes hjertecentre til vurdering til hjertetransplantation/LVAD på transplantationscentrene på Aarhus Universitetshospital og Rigshospitalet.
Patienterne udredes på transplantationscenteret for at afsløre følgende tilstande, som kontraindicerer hjertetransplantation absolut eller relativt:
- fikseret forhøjet lunge-karmodstand
- perifer arteriel insufficiens
- aktiv infektion
- kronisk lungesygdom
- kronisk nyre- eller leverinsufficiens (som ikke skyldes hjertesvigt eller behandling)
- systemsygdom, HIV, nylig (< 5 år) cancersygdom
- ringe compliance eller psykisk sygdom, som må forventes at medføre complianceproblemer
- aktivt misbrug (herunder rygning eller alkoholisme)
Ofte er kontraindikationerne relative, og konference med transplantationscenter anbefales.
5.10.2 Palliation ved fremskreden hjertesygdom
En del patienter med svær hjertesvigt vil ikke være kandidat til mere avanceret hjertesvigtsterapi pga. svær komorbiditet. Sådanne patienter med forventet levetid under 1 år bør skiftes til palliativ terapi, såfremt patienten selv ønsker det, mhp. at reducere symptomer og forbedre livskvalitet. Palliativ behandlingsindsats og end-of-life drøftelser inkl slukning af ICD-terapier bør tilbydes patienter i den præterminale eller terminale fase, der er karakteriseret ved progredierende symptombyrde, hyppige indlæggelser, multiorgan dysfunktion, stigende komobiditetsbyrde og gentagen ICD-terapi. Videnskabelig evidens på området er sparsom, men indsatsen kan evt. udføres af palliative teams gennem tidlig diagnosticering efter individuel vurdering for at fremme livskvaliteten, mindske symptombyrden og reducere genindlæggelser. Den palliative indsats ved hjertesvigt adskiller sig fra de maligne sygdomsforløb, og en detaljeret beskrivelse kan læses i et holdningspapir fra DCS.
Behandlingsmålene skifter fra et livsforlængende sigte mod at dække palliative behov af fysisk, psykisk, social og eksistentiel karakter omfattende:
- samtale hvor patienten og pårørende forberedes om sygdommens prognose, herunder mulighed for inaktivering af ICD-enhed
- justering af den livsforlængende medicinske behandling (se: Tabel 5.2, Tabel 5.3, Tabel 5.4) til fordel for optimal symptomkontrol og livskvalitet
- evt. overvejelse om terminalerklæring (LÆ165) og terminal medicintilskud
- koordineret tværfaglig optimal individualiseret pleje mellem hjertesvigtklinikken, sengeafsnittet, hjemmeplejen, egen læge og/eller palliativ team
Den optimale varetagelse af den uafvendeligt døende patient vil være afhængig af det individuelle forløb og kardielle kompleksitet.
5.11 ”Hjertesvigt og overgang til det nære sundhedsvæsen”
Behandlingsmål
Målet for behandlingen af hjertesvigtspatienter er at reducere morbiditeten og mortaliteten, samt forbedre livskvaliteten som beskrevet i punkt 5.1 og 5.5
Tidspunkt for kontrol efter opnåelse af behandlingsmål
Et sygdomsforløb med hjertesvigt er uforudsigeligt. Efter relevant guidelinebaseret behandling af patienter med hjertesvigt, omfatter afsluttende kontrol i sygehusregi: Vurdering af patientens status, medicinering, devicebehandling, komorbiditet samt ekkokardiografi. Der tages stilling til evt. supplerende behandling/udredning.
- Mange patienter vil kunne afsluttes til kontrol ved egen læge eller til fortsatte kontroller i sygehusregi (fx ved behov for kontrol af klaplidelse, Cordaronekontroller eller pacemakerbehandling/kontroller).
- Visse patienter vil efter individuelt skøn fortsætte i kontrolforløb i sygehusregi. For patienter med hjertesvigt, som i forbindelse med guidelinebaseret behandling er opstartet i ARNi behandling, bør følges op med henblik på effekten af ARNi.
- Stabile patienter med svære symptomer (LVEF <40% og NYHA III-IV) bør følges hyppigere (typisk hver 3.-6. måned) i sygehusregi, såfremt det skønnes at det kan have behandlingsmæssige konsekvenser.
- Patienter, der er potentielle kandidater til avanceret hjertesvigtsbehandling såsom evt. hjertetransplantation eller LVAD implantation, forventes at blive kontinuerligt fulgt i sygehusregi med individuelt vurderede intervaller (typisk hver 3.-6. måned).
- Hertil kommer patienter med palliative behov, som flere steder følges i palliative forløb med tæt opfølgning enten fra palliative teams (enkelte med en vis forankring i kardiologisk regi) eller akutteams.
Interval for kontroller ved stabil tilstand
- For patienter med stabil tilstand vil et typisk kontrolforløb hos egen læge bestå af kontrol ca. hver 6.-12. måned, hvor der er fokus på subjektive og objektive symptomer på hjertesvigt. Det vil dreje sig om graden af åndenød, grad af trætbarhed, tiltagende/nytilkomne brystsmerter, tiltagende/nytilkomne hjertepalpitationer, tiltagende/nytilkomne tegn på væskeretention og nytilkomne besvimelsestilfælde. Yderligere vil vægtkontrol, blodtryk, EKG samt relevante blodprøver.
- For patienter med stabil tilstand (LVEF ≤40% og NYHA I-II) skal kontrollerne bestå af en årskontrol og 2-3 yderligere kontroller afhængigt af alder og komorbiditet.
- Det forventes at patienter med forværring i tidligere erkendt hjertesvigt indlægges eller som minimum konfereres med lokalsygehuset, hvis de er afsluttede herfra.
Parametre, der indgår i kontrollen
- sikring af compliance, såvel non- som farmakologisk
- fokus på subjektive og objektive symptomer på hjertesvigt (åndenød, deklive ødemer, brystsmerter osv.)
- kontrol symptomgrad (NYHA)
- vægtkontrol
- måling af blodtryk og puls/rytme
- kontrol af blodprøver: S-kreatinin, S-Na+, S-K+, og evt. supplerende afhængig af evt. comorbiditet (1-2 gange årligt)
- EKG min. 1 gang årligt
- Faktorer, der taler for genetablering af kontakt til hjertesvigtsambulatoriet:
a. Subjektivt: Overvej kontakt til hospitalet:
- ved subjektiv og objektiv forværring beror en evt. henvendelse på den henvisende læges skøn
- forværring af NYHA-klasse trods moderat ændring i diuretika (f.eks. fordobling af diuretikadosis)
- tiltagende/nytilkomne brystsmerter, hjertepalpitationer, tegn på væskeretention eller besvimelsestilfælde
- stød fra ICD skal altid foranledige kontakt til hospitalet
- behov for reduktion af guidelinebaseret medicinsk hjertesvigtsbehandling bør også foranledige kontakt til hospitalet
b. Objektivt: Overvej henvisning til kardiologisk afdeling ved:
- forværring i NYHA-klasse
- behandlingsrefraktær hypertension
- vedvarende fald i systolisk BT til <90 mmHg med ledsagesymptomer
- nytilkommet venstresidigt grenblok hos patienter uden CRT
- nytilkommen mislyd, arytmier, refraktære ødemer/lungestase
- hvis patienten ikke længere tolererer hjertesvigtsmedicin
c. Paraklinisk: Overvej kontakt til kardiologisk afdeling ved:
- opstart af ARNi skal sanktioneres af speciallæge i kardiologi
- opstart af SGLT-2 hæmmer til patienter med HFrEF uden type 2 diabetes mellitus og nyresygdom bør foregå efter konference med den lokale hjertesvigtsklinik
- derangerede nyretal (stigning i kreatinin/væsketal og/eller levertal uden anden oplagt forklaring)
- hyponatriæmi udløst af hjertesvigtsbehandling