11. Sygdom i aorta
11.1 Akut aortasyndrom
11.1.1 Definition
Akut aortasyndrom omfatter en række akutte tilstande i aorta: aortadissektion, intramuralt hæmatom og penetrerende aorta ulcus.
Aortadissektionen opstår som følge af en intimalæsion, hvorved blodet presses ud i karvæggen, som spaltes eller rumperer, og inddeles i:
Type A-dissektion (Stanford-klassifikation)
- alle dissektioner, der involverer aorta ascendens
- dissektionen kan optræde lokalt i ascendens (DeBakey type II) eller udbredes videre til arcus og descendens (DeBakey type I). Alle aortas sidegrene kan være involverede
- hæmoperikardium, akut aortaklapinsufficiens og involvering af koronar arterierne (hyppigst højre) kan ses
Type B-dissektion (Stanford-klassifikation)
- dissektion distalt for afgangen af venstre arteria subclavia
Arcus-dissektion
- dissektioner, som opstår mellem truncus brachiocephalicus og venstre arteria subclavia. Disse udgør ca. 10% af alle aortadissektioner. De er ikke indbefattet i Stanford-klassifikationen, og betegnes non-A non-B dissektion
Det intramurale hæmatom opstår primært som en blødning i karvæggen, som evt. kan penetrere videre til lumen eller rumpere helt.
Det penetrerende aorta ulcus (PAU) defineres som ulceration i et aterosklerotisk plaque i aortavæggen, der penetrerer ind i media.
11.1.2 Disponerende faktorer
- alder
- mandligt køn
- rygning
- hypertension
- syndromassocieret arvelig aortasygdom (Marfans syndrom, Turners syndrom, Loeys-Dietz’ syndrom, vaskulær Ehlers-Danlos’ m.fl.)
- bicuspid aortaklap
- hereditær thorakal aortadissektion eller aneurisme (HTAD)
11.1.3 Symptomer og kliniske præsentationer
11.1.4 Diagnostik
Akut aortasyndrom er en differentialdiagnose til akut myokardieinfarkt, lungeemboli og pneumothorax ved akut opståede brystsmerter. Kardinalsymptomet ved det akutte aortasyndrom er pludseligt indsættende kraftige smerter i bryst, ryg og/eller abdomen, som ofte beskrives rivende eller skærende. Der kan være ledsagende neurologiske udfald (Tabel 11.1).
Den kliniske diagnose kan kvalificeres ved hjælp af et simpelt score system (Aortic Dissection Detection Risk Score (ADD-RS)), som er baseret på risikofaktorer, symptomer og kliniske fund (Tabel 11.2).
Billeddiagnostik
Den diagnostiske strategi baseres på á priori sandsynligheden for tilstedeværelse af aortadissektion (risikofaktorer, klassiske symptomer og kliniske fund). Den primære undersøgelse er en computer tomografi (CT)-aortografi, som bør være EKG-gated. En CT-aortografi uden EKG-gating kan have så betydelige bevægelsesartefakter i aorta ascendens, at en aortadissektion kan overses eller ikke sikkert udelukkes. Ved CT-aortografien kan involvering af halskarrene, og karrene til vitale organer vurderes, og kirurgerne kan vurdere vaskulære adgangsforhold mhp. operation eller anlæggelse af aortastent.
Transthorakal ekkokardiografi (TTE) kan identificere evt. ledsagende aortaklapinsufficiens, om der er hæmoperikardium, og evt. påvise dissektionsmembran, men TTE kan ikke udelukke en dissektion.
Transøsofageal ekko (TEE) anvendes primært på operationsstuen til fastlæggelse af sværhedsgraden af aortainsufficiens, hjertets pumpefunktion og lokalisation af dissektionens entry i aorta ascendens.
Fibrin D-dimer
Fibrin D-dimer anbefales ikke anvendt diagnostisk hos patienter med høj klinisk sandsynlighed for akut aortasyndrom
- klassisk aortadissektion (både A og B) er typisk forbundet med tidlig betydelig forhøjelse af fibrin D-dimer
- ved intramuralt hæmatom kan normal fibrin D-dimer i sjældne tilfælde forekomme
- normal fibrin D-dimer ved lav klinisk sandsynlighed udelukker aortadissektion
11.1.5 Behandling
Behandling af type A-dissektion
Principielt er der akut operationsindikation, og alle patienter bør konfereres med hjertecenter, hvor endelig behandlingsstrategi, herunder om patienten er kandidat til operation, fastlægges af hjerteteamet. Ved operation foretages udskiftning af aortaroden, evt. kombineret med udskiftning af aortaklappen.
Behandling af hæmoperikardium
Ved hæmoperikardium bør der kun foretages pericardiocentese ved manifest svær tamponade/pulsløs elektrisk aktivitet. Efter ultralydsvejledt anlæggelse af perikardiedræn udtømmes kun blod indtil der opnås cirkulation, ofte < 50 ml, hvorefter drænet afklemmes og lades in situ. Beslutning om at udføre pericardiocentese bør om muligt konfereres med thoraxkirurg.
Behandling af type B-dissektion (inkl. opereret type A-dissektion)
Patienter med verificeret type B-dissektion overflyttes som udgangspunkt til eller konfereres med hjertecenter. Før overflytning bør man tilstræbe blodtrykskontrol (systolisk blodtryk < 120 mmHg, dog < 110 mmHg ved syndromassocieret arvelig aortasygdom):
- intravenøs antihypertensiv behandling med labetalol og/eller nitroglycerin, som gradvist erstattes af peroral behandling (Kapitel 27: Arteriel hypertension)
- ved kompliceret B-dissektion, dvs. kompromitteret flow til vitale organer eller ruptur, er der akut indikation for perkutan aortastent (TEVAR - Thoracic EndoVascular Aortic Repair)
- andre forhold der bør give anledning til overvejelser om TEVAR (akut eller subakut) er kompression af omgivende strukturer, vedvarende smerter eller hastig progression i aortadiameter
- B-dissektion med kompromitteret blodforsyning til vitale organer kan i udvalgte tilfælde behandles med kateterbaseret fenestrering af membranen mellem det falske og sande lumen
- mulighed for spinaldrænage ved tegn på spinal iskæmi (paræstesi/paraplegi)
Behandling af arcus-dissektion (non-A non-B type)
Patienter med dissektion i arcus kan ikke behandles med isoleret TEVAR og bør derfor drøftes i hjerteteamet mhp. evt. kirurgisk intervention. Valg mellem intervention og konservativ behandling skal ske efter et individuelt skøn, hvor der tages hensyn til patientens alder, komorbiditet og omfanget af sygdom i aorta.
Behandling af intramurale hæmatomer
Intramuralt hæmatom er at betragte på lige fod med dissektion og behandles efter samme principper som beskrevet ovenfor.
Behandling af penetrerende aorta ulcus (PAU)
- PAU ledsaget af ruptur eller intramuralt hæmatom behandles som udgangspunkt med intervention (kirurgi/TEVAR)
- symptomatisk PAU behandles som udgangspunkt på lige fod med andre former for akut aortasyndrom
- asymptomatisk PAU følges billeddiagnostisk mhp. estimering af højrisiko karakteristika (størrelse, sacculat form, ledsagende pleura effusion) og progression
Traumatisk thorakal aortaskade
Forekomsten af traumatisk thorakal aortaskade i Danmark er ukendt, men er internationalt rapporteret at være den anden hyppigste dødsårsag hos traumepatienter, og der bør foretages CT-aortografi efter stumpt højenergi traume, såsom trafikuheld eller fald fra stor højde for at udelukke thorakal aortaskade. Traumatisk aortaskade inddeles i grad 1-4; intima rift, væg-hæmatom, pseudo-aneurisme og total ruptur. Valg mellem konservativ eller operativ/endovaskulær behandling afhænger af patientens stabilitet, grad af aortaskade, andre samtidige skader samt billeddiagnostiske karakteristika. Ved identifikation af aortaskade hos traumepatienten bør patienten drøftes akut med højt specialiseret center.
Persisterende dissektion
- optræder hos 75-90% af opererede A-dissektioner og ikke-opererede B-dissektioner, og næsten alle har varierende grader af flow i det falske lumen
- mangelfuld blodtrykskontrol medfører på kort og lang sigt 10 gange øget risiko for letal ruptur. Sufficient livslang behandling og kontrol af blodtryk er derfor af største vigtighed, uanset om der er persisterende dissektion eller ej,
Dødsfald hos patienter under 60 år eller kendt familie aortasygdom
Ved yngre patienter under 60 år bør man ved dødsfald i forbindelse med aortadissektion sikre fuldblod (f.eks. to EDTA-glas) til mulig senere post-mortem genetisk udredning.
11.1.6 Prognose
Type A-dissektion
Uden operation er mortaliteten ca. 1% pr. time de første 48 timer og ca. 75% efter 2 uger. Ved operation er den perioperative mortalitet ca. 20% og 5 års overlevelsen ca. 75%.
Type B-dissektion
Efter medicinsk behandling er mortaliteten ca. 5-8% inden for 14 dage og overlevelsen efter 5 år er 70-80%. Når en type B-dissektion nødvendiggør operation eller stentbehandling, er den perioperative mortalitet ca. 25%, men herefter er overlevelsen som ved medicinsk behandlet type B-dissektion.
11.1.7 Kontrol efter aortadissektion
- vigtigst er blodtrykskontrol med et blodtryk (se Kapitel 27: Arteriel hypertension). Det anbefales, at betablokker i højeste tolererede dosis indgår i behandlingen.
- modificering af øvrige risikofaktorer i form af rygestop og kolesterolsænkende behandling, se Kapitel 28: Dyslipidæmi
- billeddiagnostisk kontrol med CT/magnetisk resonans (MR) af aorta totalis foretages 1-3 måned(er) post-dissektion, og herefter som udgangspunkt hver 12. måned mhp. at detektere progression af sygdom i stentede områder, i dele af aorta med persisterende dissektion (f.eks. i arcus og descendens efter rodsubstitution) samt sygdom i andre, tidligere ikke afficerede dele af aorta)
- aortainsufficiens følges efter guidelines for klapsygdomme (se Kapitel 6: Hjerteklapsygdom).
- Ved ca. 20% af thorakale aortasygdomme er der en monogenetisk eller hereditær ætiologi, hvorfor der bør undersøges for underliggende sygdom, herunder udspørge om familiær forekomst af aortasygdom eller pludselig død. Vejledende kriterier for henvisning til en klinik for arvelige hjertesygdomme er:
- mere end et tilfælde i familien med thorakalt aortaaneurisme / dissektion / bikuspid aortaklap / tidlig pludselig død
- alder < 50 år
- overvejes ved alder 50-60 år ved fravær af anden oplagt ætiologi
- ved mistanke om syndromassocieret arvelig aortasygdom (Marfans syndrom, Turners syndrom mfl.) bør patienten henvises til genetisk udredning ved Center for Sjældne Sygdomme eller klinisk genetisk afdeling (de kliniske karakteristika for Marfans syndrom kan findes her: Link, og for Turners syndrom her: Link)
En del patienter udvikler tiltagende dilatation af det falske lumen, re-dissektion eller ruptur og/eller nye symptomer i form af smerter eller trykkende ubehag. I så fald er der umiddelbar indikation for fornyet billeddiagnostik og overvejelser omkring intervention. Patienterne skal informeres om at henvende sig uden for planlagt kontroltidspunkt ved symptomer og tilrådes akut indlæggelse via 112 ved pludseligt opståede smerter i bryst, ryg og/eller abdomen, hvor man bør foretage akut CT-aortografi. Behandling af progressiv aortadilatation efter dissektion sker på højt specialiseret center.
11.1.8 Aktivitetsrestriktioner
Patienter med rest-dissektion efter operation samt de som er konservativt behandlet for aortadissektion, frarådes kontaktsport samt svær isometrisk belastning (erhverv/sport). Det anbefales, at patienten træner, hvor løft ikke kræver brug af valsalva manøvre og ikke mere intensivt end, at man samtidig kan sige en sammenhængende sætning. Hvis der efter operation ikke resterer restdissektion, er der ingen evidens for begrænsninger i fysisk aktivitet, fraset ved syndromassocieret aortasygdom, se afsnit 11.2.6.3. Der henvises desuden til Kapitel 29: Hjerterehabilitering.
11.1.9 Graviditet
Kvinder i den fertile alder med fremtidigt graviditetsønske bør henvises til prækonceptuel vurdering og rådgivning på højt specialiseret center for gravide med hjertesygdom.
11.2 Thorakalt aortaaneurisme
11.2.1 Forekomst
Incidensen er angivet til 10-15 per 100.000 per år og er formentligt underestimeret, da mange aneurismer er asymptomatiske.
11.2.2 Definition
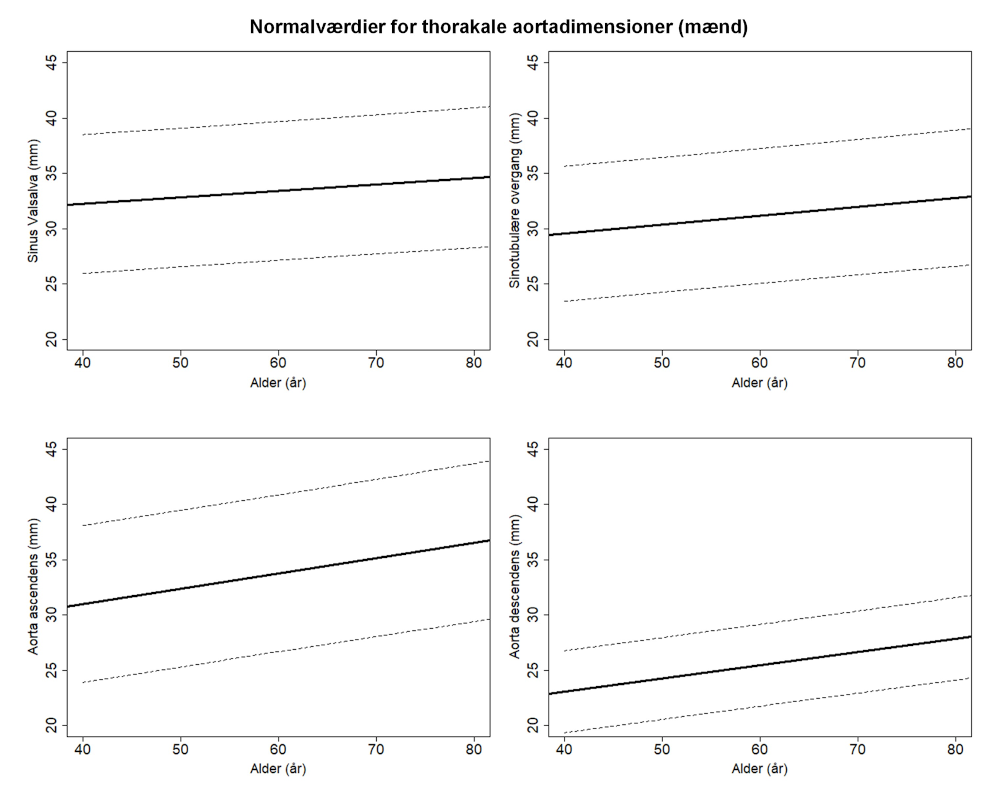
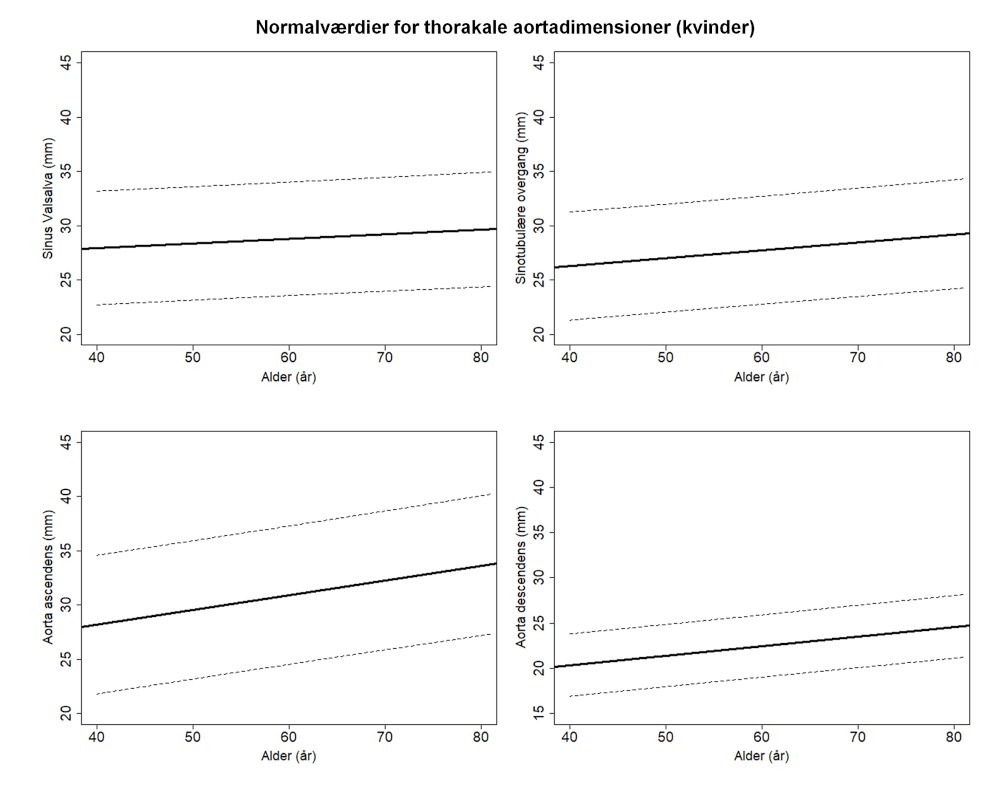
Aortas diameter afhænger af alder, køn og legemsoverflade (se Tabel 11.3 og normogrammer i Figur 11.1). Hos patienter hvor højde eller Body Surface Area (BSA) afviger væsentligt (typisk >2SD) fra gennemsnittet, må dette tages i betragtning ved vurdering af aortas diameter. Typisk korrigeres ved anvendelse af Z-score eller ”Aorta Size Index (ASI)” med beregning af ratio mellem aorta diameter og BSA.
I praksis er aortaroden/ascendens klinisk signifikant dilateret ved en diameter over 4 cm hos voksne med normal legemsoverflade, og de bør som udgangspunkt følges efter principperne anført i afsnit 11.2.6.
11.2.3 Disponerende faktorer
- hypertension
- alder, mandligt køn, dyslipidæmi, diabetes og rygning
- syndromassocieret arvelig aortasygdom (Marfans syndrom, Turners syndrom, Loeys-Dietz’ syndrom, vaskulær Ehlers-Danlos’ syndrom, m.fl.)
- hereditær thorakal aortadissektion eller aneurisme (HTAD)
- bicuspid aortaklap
- poststenotisk dilatation ved valvulær aortastenose
- infektioner og inflammatoriske bindevævssygdomme
11.2.4 Inddeling
- 75% af aneurismer er lokaliseret i aorta ascendens
- 5% er lokaliseret i arcus aorta
- 20% i aorta descendens
- kun få procent er thorako-abdominale aneurismer
11.2.5 Diagnostik
Symptomer
- mange thorakale aortaaneurismer er asymptomatiske
- tryksymptomer kan forekomme i form af dysfagi, dyspnø, hæshed (recurrens parese), bryst- og rygsmerter
Indledende udredning
- TTE til påvisning og karakteristik af ascendens aneurismer, vurdering af klapmorfologi og funktion, samt ventrikelfunktion
- CT- eller MR-aortografi mhp. lokalisation og opmåling af aneurismets største diameter. Hele aorta skal undersøges, da dilatation/aneurisme kan optræde i flere dele af aorta (hos ca. 25%)
- opmåling af aorta diameter bør foretages ved et reproducerbart anatomisk pejlemærke såsom sinus Valsalva, sinotubulær overgang, ascendens og descendens ved truncus pulmonalis niveau, samt arcus aorta
- hjerte-CT, evt. KAG udføres før elektiv profylaktisk operation
- ved mistanke om aortitis (se også afsnit 11.3) suppleres med relevante inflammatoriske biomarkører og evt. fluorodeoxyglucose position emissions tomografi (FDG-PET)
- ved mistanke om syndrom associeret arvelig aortasygdom (Marfans syndrom, Turners syndrom mfl.) bør patienten henvises til genetisk udredning ved Center for Sjældne Sygdomme eller klinisk genetisk afdeling (de kliniske karakteristika for Marfans syndrom kan findes her: Sundhed.dk (Marfans syndrom), og for Turners syndrom her: Sundhed.dk (Turners syndrom))
- adspørg om familiær ophobning af aortasygdom (se DCS Rapport vedrørende Arvelige Hjertesygdomme)
11.2.6 Opfølgning og behandling
Patienterne følges generelt med TTE, EKG-gated CT-aortografi eller MR-aortografi. Man bør være opmærksom på, at skift af billedmodalitet kan give betydende udsving i angivelse af størrelse.
Blodtrykssænkende behandling er essentiel, målblodtryk generelt under 130 / 80 mmHg, dog ved syndromassocieret arvelig aortasygdom under 110/80 mmHg (hjemme eller døgnblodtryk, se også Kapitel 27: Arteriel hypertension). Betablokker bør indgå som et led i behandlingen mhp. reduktion af aortas vægspænding. Når behandlingsmålet er nået, bør blodtrykket kontrolleres halv- til helårligt, hvilket hos stabile patienter typisk kan varetages i almen praksis.
Reduktion af kardiovaskulære risikofaktorer er essentielt i behandlingen ved aterosklerotisk betinget sygdom, hvor livsstilsændringer, evt. lipidsænkende og antitrombotisk behandling (se også Kapitel 33: Perifer arteriesygdom) samt rygeophør indgår, da disse er stærkt forbundet med aneurisme-dannelse.
Behandling af betydende aortaaneurismer i ascendens er kirurgisk, mens stentbehandling foretrækkes ved descendens aneurismer.
Opfølgning og behandling afhænger af genesen for aortadilatationen som anført nedenfor. Kontrolforløb kan ophøre, når det vurderes, at den kirurgiske risiko ved forebyggende operation / TEVAR overstiger risikoen for spontan dissektion. Hos patienter der afsluttes, anbefales at blodtrykket fortsat kontrolleres halv- til helårligt, hvilket typisk kan varetages i almen praksis.
Tricuspid aortaklap (og hypertensionsbetinget) thorakal aortadilatation
- kontrolintervaller fastsættes efter aortadilatationens størrelse. TTE-kontrol anbefales som minimum årligt for de med diameter over 5,0 cm, hvert 1-2. år ved diameter over 4,5 cm, og hvert 3. år for de med diameter ≤4,5 cm. Ved progression af aortadilatation samt ved udvikling af klapinsufficiens kan hyppigere kontroller planlægges
- CT-/MR-aortografi udføres med længere intervaller alt afhængig af lokalisation, vækstrate, og indbliksforhold ved TTE
- operationsindikation i ascendens ved diameter ≥5.5 cm og i descendens ved diameter ≥5,5 cm hvis TEVAR er muligt. Er åben kirurgi eneste behandlingsmulighed bør dette overvejes ved diameter ≥6,0 cm
- ved anden indikation for hjertekirurgi bør man overveje samtidig kirurgi på aorta ascendens ved diameter over 4,5 cm
- det kan overvejes at ophøre kontroller efter 6 år såfremt der har været helt stationære dimensioner og aorta diameter er under 5,0 cm
11.2.6.1 Bicuspid aortaklap og thorakalt aortaaneurisme
- kontrolintervaller og modaliteter følger overordnet kriterier som ved tricuspid aortaklap, med mindre sværhedsgrad af klapsygdom indicerer hyppigere kontrol
- dilatation ses som enten dilatation af hele aorta ascendens med udslettet sinotubulær overgang eller dilatation af distale ascendens lige under truncus brachiocephalicus (sidstnævnte kan være svær at visualisere ved TTE og kræver indblik fra jugulum eller parasternalt view i IC2/IC3)
- særlig fokus på evt. coarctatio, subaortaobstruktion og koronaranomalier
- operationsindikation ved diameter ≥5,5 cm, eller ≥5,0 cm ved risikofaktorer (coarctatio, dilatation af aorta roden såkaldt ”Rod fænotype”, hypertension, familiær disposition til aortadissektion eller progressiv dilatation over 3 mm/år).
- ved anden indikation for hjertekirurgi bør man overveje samtidig kirurgi på aorta ascendens ved diameter ≥4,5 cm
11.2.6.2 Syndromassocieret aortaaneurisme (Marfans syndrom, Turners syndrom, Loeys-Dietz’ syndrom m.fl.)
- følges på højtspecialiseret center (AUH/RH) i samarbejde med Center for Sjældne Sygdomme samt de klinisk genetiske afdelinger, som står for den genetiske udredning (se også guidelines fra Dansk Selskab for Medicinsk Genetik)
- årlig TTE og MR-aortagrafi af aorta totalis efter individuel vurdering (typisk hvert 2.-3. år afhængigt af indblik ved TTE)
- ved Marfans syndrom, på grund af øget risiko for aortadissektion, anbefales profylaktisk operation ved diameter ≥5,0 cm eller væksthastighed ≥3 mm/år (vurderet ved samme billedmodalitet)
- ved familiær ophobning af aortadissektion ved aortadiameter under vanlig interventionsgrænse eller ved graviditetsønske (se også kapitel 31 Graviditet og hjertesygdom) anbefales profylaktisk operation ved diameter ≥4,5 cm. Ved sidstnævnte bør patienten være set af GUCH-Obstetriker-Anæstesiologisk specialteam på højtspecialiseret center forud for graviditet
- patienter med Loeys Dietz’ syndrom opereres typisk på lavere diametre afhængigt af specifik genvariant, ekstraaortal fænotype, familiehistorie og aorta vækstrate. Viden er beskeden, og der er ofte tale om en individuel vurdering
- kvinder med Turners syndrom tilbydes operation ved en indekseret aortastørrelse på 2,5 cm/m2, eller ved en absolut diameter ≥4 cm
- der foreligger ikke data omkring aortadimensioner til at guide profylaktisk aortakirurgi ved de mindre hyppige sygdomme såsom vaskulær Ehlers-Danlos’ syndrom (vEDS). Beslutning om interventionel behandling bør tages på højtspecialiseret MDT-konference
- alle med syndromer følges livslangt pga. risiko for yderligere aortasygdom
- behandling med angiotensin receptor blokker og/eller betablokker i maksimale tolererede doser anbefales som forebyggende mod aortadilatation ved Marfans syndrom
- gentagne tunge vægtløft, der kræver anvendelse af valsalva-manøvre, samt kampsport bør undgås hos patienter med syndromassocieret aortadilatation
11.2.6.3 Hereditær thorakalt aortaaneurisme (HTAD, tidligere non-syndromassocieret arvelig aortaaneurisme)
- HTAD bør overvejes ved forekomst af aortaaneurisme/-dissektion hos én yngre
- ved erkendt aortadilatation foretages løbende TTE og CT-/MR-aortografi efter individuel vurdering
- operationsindikation vanligt ved diameter ≥5,5 cm. Ved familiær ophobning af aortadissektion ved diameter ≥5,0 cm
- klinisk og genetisk udredning af index-patient og familiemedlemmer foregår i kardiologisk regi via klinik for arvelige hjertesygdomme, evt. i et samarbejde med klinisk genetisk afdeling (se Guideline, Dansk Selskab for Medicinsk Genetik)
- førsteleds slægtninge, der på baggrund af familieudredning og evt. prædiktiv gentest findes arvelig disponeret til thorakal aortasygdom, tilbydes TTE og blodtrykskontrol fra 25 års-alderen (eller 10 år før tidligste debut i familien ved tilfælde før 35 års-alderen), evt. MR-aortografi hvert 5. år indtil evt. påvist aortadilatation. Screening ophører som udgangspunkt ved 70 år
11.3 Aortitis
Inflammation i aorta, aortitis, inddeles i non-infektiøs og infektiøs, hvor non-infektiøs ætiologi, der inkluderer Kæmpe celle arteritis og Takayasus arteritis, er hyppigst. Bakteriel ætiologi inkluderer stafylokokker, Salmonella, mykobakterier, E. Coli, og Treponema pallidum. Et præeksisterende plaque eller pseudoaneurisme kan være sæde for infektionen. Udredning og behandling foretages som multidisciplinært samarbejde mellem rheumatologer, infektionsmediciner, mikrobiologer, kardiologer og/eller evt. thoraxkirurger. Billeddiagnostisk ses fortykkelse af aortavæggen ved MR- eller CT-aortografi og opladning ved PET/SPECT ved både non-infektiøs og infektiøs aortitis. Gennemdyrkning mhp. identifikation af agens er essentiel ved mistanke om infektiøs årsag. Behandling afhænger af ætiologi (immunosuppressiva, længerevarende antibiotika), og kirurgi eller endovaskulær behandling kan være indiceret ved manifest eller truende ruptur. Empirisk antibiotisk behandling skal dække de mest oplagte bakterier (stafylokokker og gram negative bakterier).