12. Lungeemboli og dyb venetrombose
Samlebetegnelsen for lungeemboli (LE) og dyb venetrombose (DVT) er venøs tromboemboli (VTE).
12.1 Lungeemboli
12.1.1 Definition
LE er en total eller delvis trombotisk aflukning af en lungearterie.
12.1.2 Forekomst
LE er en relativt hyppig tilstand med ca. 4000 nye registrerede tilfælde om året i Danmark.
12.1.3 Ætiologi
Embolisering fra DVT i bækkenets eller underekstremiteternes vener er langt den hyppigste årsag til LE. Blandt patienter med LE har ca. 80% også DVT (kun 15% har symptomer). Blandt patienter med symptomatisk DVT har ca. 50% også LE (kun 5% har symptomer).
Disponerende faktorer for VTE er især nylig operation, immobilisation, graviditet og cancer, men adskillige øvrige faktorer disponerer ligeledes. I op mod 40% af tilfældene opstår VTE hos tidligere raske personer uden oplagte risikofaktorer.
12.1.4 Symptomer og kliniske fund
Symptomer
Typiske symptomer er åndenød, hoste og hjertebanken, ligesom diagnosen også bør mistænkes ved uforklaret synkope/nærsynkope, brystsmerter og/eller hæmoptyse. Typiske objektive fund er hypoksi og sinustakykardi. Vurderingen af sandsynligheden for LE beror på en samlet klinisk vurdering, eventuelt understøttet af scoringssystemer såsom Wells’ LE score (Tabel 12.1).
12.1.5 Udredning
Klinisk undersøgelse
Den kliniske sandsynlighed for LE vurderes. Herudover vurderes graden af kredsløbspåvirkning i form af blodtryk, puls og saturation.
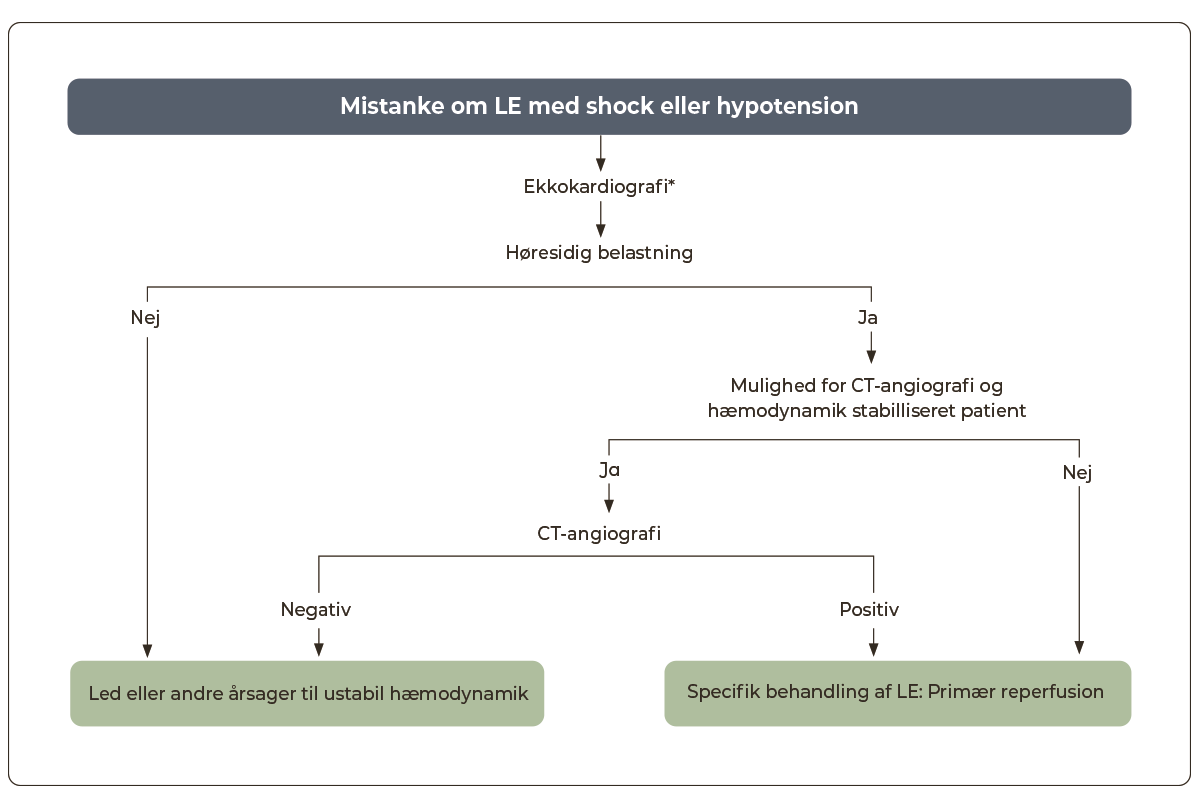
Mistanke om lungeemboli hos hæmodynamisk ustabil patient.
Hos patienter med mistanke om LE, som opfylder et af nedenstående kriterier for hæmodynamisk ustabilitet, følges nedenstående algoritme for akut udredning og behandling (Figur 12.1).
1) Behov for hjertelungeredning
2) Systolisk blodtryk 90mmHg samt tegn til organhypoperfusion (ændret mental status, kolde ekstremiteter, oliguri/anuri eller øget laktat)
3) Systolisk blodtryk
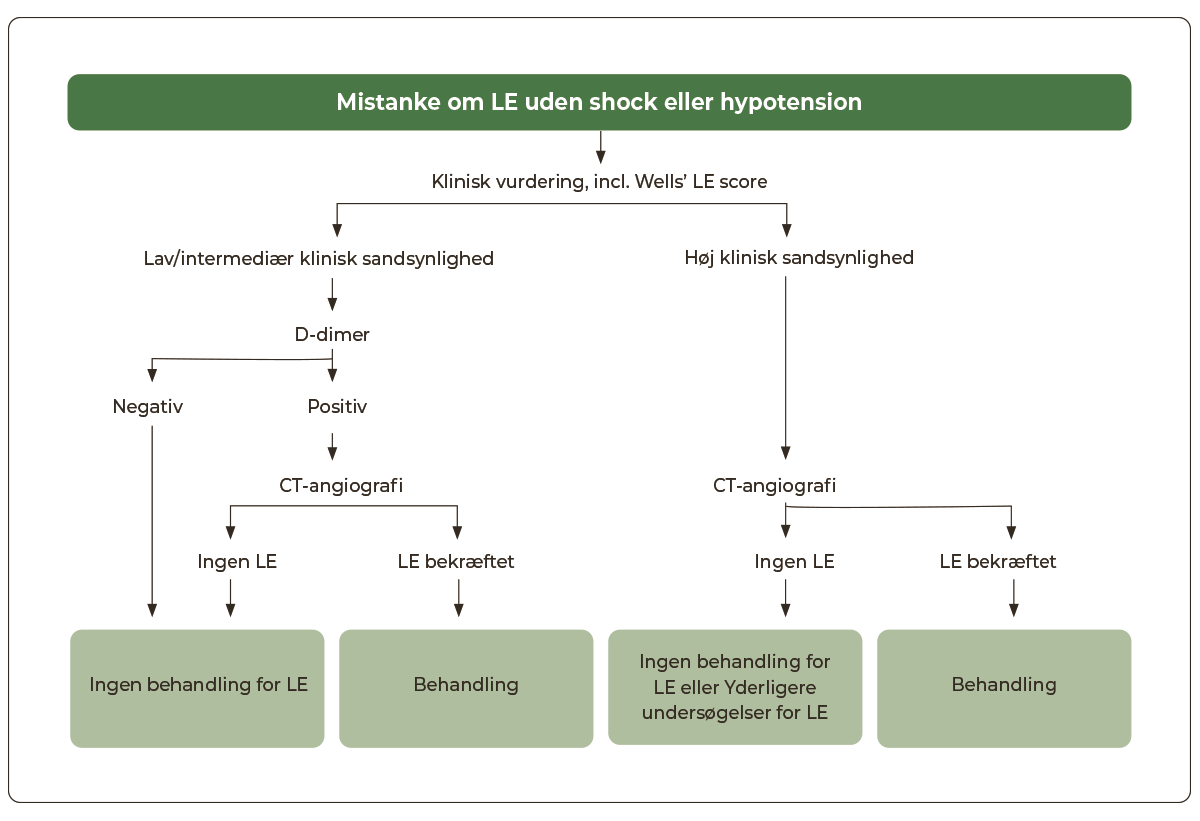
Mistanke om LE hos stabile patienter.
Hos hæmodynamisk stabile patienter med mistanke om LE følges nedenstående algoritme for udredning og behandling (Figur 12.2)
Parakliniske undersøgelser
D-dimer
D-dimer er et nedbrydningsprodukt af fibrin og bruges primært til at udelukke LE hos patienter med lav/intermediær klinisk sandsynlighed (negativ prædiktiv værdi 99%). Måling af D-dimer er således ikke indiceret hos patienter med høj klinisk sandsynlighed for LE, idet prøven i denne population har en utilstrækkelig negativ prædiktiv værdi (80%). Disse patienter bør under alle omstændigheder udredes billeddiagnostisk.
D-dimer er ofte forhøjet af andre årsager end VTE, især hos hospitaliserede patienter med konkurrerende sygdomme, ældre og gravide. D-dimer stiger med alderen, og anvendelse af alderskorrigeret D-dimer ved alder >50 år anbefales, da det øger testens diagnostiske præcision (alderskorrigeret cut-off = alder x 0,01 mg/l). En forhøjet D-dimer uden samtidige symptomer på LE eller DVT bør således ikke føre til udredning for LE. VTE bør dog overvejes hos patienter med uforklaret betydelig D-dimer forhøjelse.
Blodgasanalyse
Typisk ses hypoksi og hypokapni, men gastallene kan være normale. Hypoksien er oftest let korrigerbar ved ilttilskud.
EKG
Karakteristiske EKG-fund er sinustakykardi, højresidigt belastningsmønster med negative T-takker i V1-V4, QR-mønster i V1, SI-QIII-TIII-mønster samt inkomplet/komplet højresidigt grenblok. Knap 1/3 af patienterne har normalt EKG.
CT-pulmonal angiografi
CT-pulmonal angiografi er den vigtigste billeddiagnostiske undersøgelse og foretages akut ved mistanke om LE, især ved hæmodynamisk påvirkning. Det er muligt at påvise LE til subsegmentarterieniveau. En negativ CT-angiografi hos patienter med lav eller intermediær klinisk sandsynlighed (Wells’ LE score 0-6) udelukker som udgangspunkt akut LE.
CT-angiografien bidrager ligeledes til risikostratificeringen ved akut LE, da påvirkningen af højre ventrikel kan vurderes. En dilateret højre ventrikel antyder akut belastning (RV/LV-ratio ≥1, RV og LV slutdiastoliske diameter udmåles som længste afstand fra endocardium til det interventrikulære septum vinkelret på hjertes længdeakse i tilstræbt axialt 4-kammerbillede).
Ved nedsat nyrefunktion (GFR Afsnit 12.5) er CT-angiografi den foretrukne undersøgelse.
Ekkokardiografi
Det primære formål med ekkokardiografi ved akut LE er at vurdere den hæmodynamiske belastning af højre ventrikel. Belastning af højre ventrikel indgår i risikostratificeringen og danner grundlag for valg af behandling (Tabel 12.3).
Ekkokardiografiske fund, der tyder på akut belastning af højre ventrikel, inkluderer en dilateret højre ventrikel (RV/LV-ratio ≥1), diastolisk impression af ventrikelseptum mod venstre (D-form i parasternalt tværsnit), McConnells tegn (regional højre ventrikel dysfunktion med akinesi af den frie væg og bevaret bevægelighed af apex) samt trikuspidal returgradient >30 mmHg.
Typiske ekkokardiografiske fund optræder imidlertid kun hos ca. 50% af LE-patienter, og en normal ekkokardiografi udelukker ikke klinisk betydende LE hos den hæmodynamisk stabile patient.
Ekkokardiografi har derudover differentialdiagnostisk værdi (perikardieeffusion, klapsygdom, iskæmi, venstre ventrikel dysfunktion, hypertrofi, etc.) og kan påvise sjældne men vigtige bifund, herunder intrakardiel trombe og overridende trombe i et persisterende foramen ovale.
Endeligt kan undersøgelsen bidrage til at differentiere mellem akut højresidig belastning udløst af LE og kronisk pulmonal hypertension som led i anden patologi (f.eks. kronisk tromboembolisk pulmonal hypertension eller fremskreden kronisk obstruktiv lungesygdom). Ved meget høj trikuspidal returgradient (>60 mmHg) og hypertrofi af højre ventrikel må et element af kronisk pulmonal hypertension forventes.
Ekkokardiografi – hvem, hvor og hvornår?
Patienter med verificeret LE bør som udgangspunkt tilbydes ekkokardiografi. Tidspunktet for undersøgelsen afhænger af den kliniske situation.
Ekkokardiografi kan i enkelte tilfælde være primær undersøgelse i tilfælde, hvor akut CT-angiografi ikke er tilgængelig eller ved klinisk mistanke om LE og svær hæmodynamisk påvirkning (Figur 12.1). Hos alle andre patienter med mistænkt LE er den primære diagnostiske undersøgelse CT-angiografi (eller ventilations-/perfusionsskintigrafi i nogle situationer). Nedenstående er således gældende for patienter med verificeret LE.
Hos patienter med LE og hæmodynamisk påvirkning (risikostratificering ”Høj”) foretages akut ekkokardiografi. Dette bør dog ikke forsinke CT-angiografi og akut behandling (f.eks. trombolyse) (Figur 12.1).
Hos symptomatiske, men hæmodynamisk stabile patienter med LE (risikostratificering ”Lav/Intermediær”) bør ekkokardiografi ligeledes foretages akut eller subakut mhp. risikostratificering (Tabel 12.3), valg af behandlingsmodalitet og afklaring af differentialdiagnoser.
Hos hæmodynamisk stabile patienter med få eller ingen symptomer på LE er ekkokardiografi ikke obligatorisk, men anbefales foretaget subakut eller ambulant som led i differentialdiagnostisk afklaring og for at udelukke pulmonal hypertension. Ved central/udbredt embolisering anbefales dog subakut ekkokardiografi.
Ventilations-/perfusionsskintigrafi
Den foretrukne diagnostiske undersøgelse ved mistanke om LE er CT-angiografi uanset tid siden symptomdebut. Hos patienter, hvor CT-angiografi ikke er hensigtsmæssig pga. patientfaktorer (f.eks. kontrastallergi eller svært nedsat nyrefunktion) kan ventilations-/perfusionsskintigrafi anvendes som alternativ. Diagnosen LE stilles ved påvisning af mismatch mellem perfusion og ventilation. Hos ca. 30-50% kan mistanken om LE afkræftes (”lav sandsynlighed for LE”) eller bekræftes (”høj sandsynlighed for LE”), mens der hos de resterende patienter kræves yderligere billeddiagnostiske undersøgelser. Fortolkningen kan især være vanskelig hos patienter med kronisk lungesygdom. Ventilations-/perfusionsskintigrafi har høj sensitivitet for perifer LE, mens graden af central embolisering kan underestimeres. Normal perfusionsskintigrafi udelukker almindeligvis LE. Med SPECT/CT lungeskintigrafi øges den diagnostiske præcision.
Højresidig hjertekateterisation med lungeangiografi
Højresidig hjertekateterisation med måling af pulmonaltryk og selektiv lungeangiografi anvendes som udgangspunkt kun, såfremt invasiv behandling overvejes (operation eller kateterbaseret behandling).
Biokemi
Både troponiner og NT-proBNP har prognostisk værdi hos patienter med LE og anvendes til risikostratificering (Tabel 12.3), men ikke til diagnostik.
Ultralydsscanning af underekstremiteter
Anvendes ultralydsscanning med kompression, påvises DVT hos op til 80% af patienter med LE. Da specificiteten er høj (>90%), kan undersøgelsen medvirke til at sandsynliggøre LE-diagnosen, såfremt LE ikke sikkert kan påvises vha. de ovenfor beskrevne undersøgelser, eller såfremt billeddiagnostik af lunger er (relativt) kontraindiceret, f.eks. hos gravide. Ultralydsscanning anbefales ikke rutinemæssigt hos patienter med verificeret LE uden symptomer på DVT, da diagnostik af asymptomatisk DVT ikke får behandlingsmæssige konsekvenser.
Cancerudredning
Malign sygdom er en selvstændig risikofaktor for VTE, men rutinemæssig malignitetsudredning anbefales ikke. Patienter med LE (og DVT) uden stærk temporær risikofaktor bør malignitetsudredes, såfremt der er klinisk mistanke om malign sygdom baseret på grundig anamnese (organspecifikke eller generelle symptomer på malign sygdom), objektiv undersøgelse (mammae, testes, prostata, lymfeknuder, etc.), biokemi (levertal, hæmatologi, evt. PSA og cancermarkører), røntgen/CT af thorax og evt. urinstix. Ved VTE hos patienter med tidligere malign sygdom overvejes om årsagen er cancerrecidiv.
Diagnostiske overvejelser
Ved høj klinisk mistanke om LE, hvor CT-angiografi er negativ, kan det være relevant med supplerende udredning (D-dimer, ekkokardiografi, screening for DVT, ventilations-/perfusionsskintigrafi samt revurdering af CT-angiografi), ligesom anden årsag end LE til patientens symptomer overvejes. Der behandles med lavmolekylært heparin (LMH) i terapeutisk dosering, indtil der er opnået diagnostisk afklaring.
12.1.6 Prognose
LE har en 30-dages mortalitet på ca. 15% med højeste risiko i de første dage. Risikoen kan reduceres betydeligt ved hurtig diagnostik og behandling. Behandlingsstrategien tilpasses i henhold til risikostratificeringen som anført i Tabel 12.2 og Tabel 12.3.
Da højre ventrikels funktion er den vigtigste prognostiske faktor hos patienter med LE, baseres risikostratificeringen på højresidig belastning vurderet billeddiagnostisk (ekkokardiografi/CT) og biokemisk (forhøjet troponin eller NT-proBNP). Derudover benyttes det simplificerede Pulmonary Embolism Severity Index; sPESI (Tabel 12.2) til vurdering af patientens mortalitetsrisiko, særligt i forhold til at identificere patienter med lav 30-dages mortalitetsrisiko, som man kan overveje at behandle ambulant.
Tabel 12.3: Risikostratificering af LE-patienter baseret på 30-dages mortalitetsrisiko |
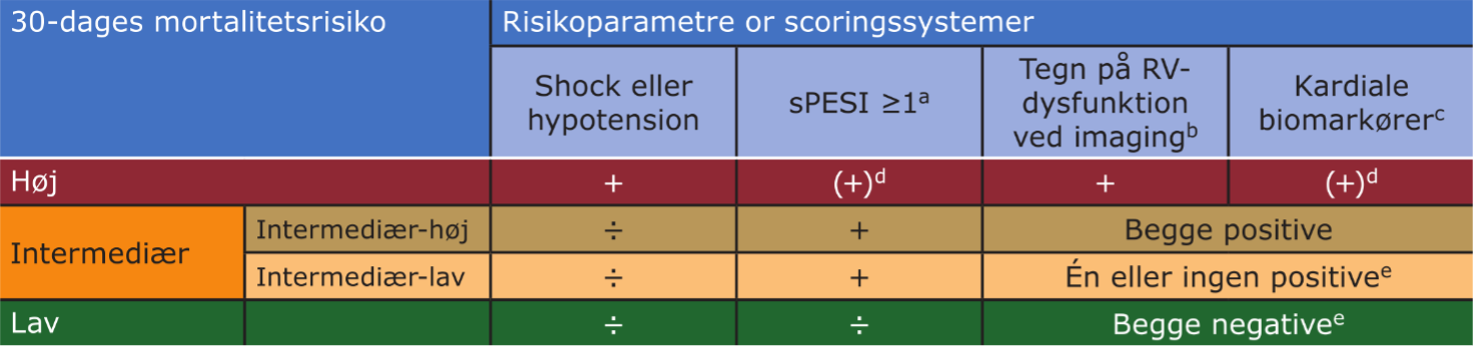 |
sPESI = simplificeret PESI (se Tabel 12.2); RV = højre ventrikel a) Hæmodynamisk ustabil defineres som mindst kriterierne: 1) Behov for hjertelungeredning, 2) Systolisk blodtryk <90 eller behov for vasopressor for at holde systolisk blodtryk >90 samt tegn til organhypoperfusion (ændret mental status, kolde ekstremiteter, oliguri/anuri eller øget laktat) 3) Systolisk blodtryk <90 mmHg eller blodtryksfald ≥40 mmHg vedvarende over 15 min. (Hvis ikke forårsaget af nyopstået arytmi, hypovolæmi eller sepsis) b) sPESI ≥1 point indikerer høj 30-dages mortalitetsrisiko c) højresidig trykbelastning enten ved transtorakal ekkokardiografi (dilateret RV, hypokinesi af RV’s frie væg og/eller øget trikuspidal returgradient) eller ved CT-angiografi (RV/LV diameter-ratio ≥1) d) TnT/TnI e) Hos en hæmodynamisk ustabil patient må yderligere risikostratificering ikke forsinke behandling. f) patienter med sPESI på 0 og forhøjede biomarkører eller højresidig trykbelastning klassificeres som intermediær-lav risiko. Patienter med sPESI på 0 men både forhøjede biomarkører og højresidig trykbelastning klassificeres som intermediær-høj risiko |
12.1.7 Behandling
Akut behandling
Ilt og kredsløbsunderstøttende behandling.
12.1.7.1 Behandlingsprincipper på baggrund af risikostratificering
Behandlingsvalget foretages på baggrund af den initiale risikostratificering (Tabel 12.3). Ved høj og evt. intermediær sandsynlighed, men ikke ved lav sandsynlighed (jf. Wells’ LE score) påbegyndes behandlingen umiddelbart, mens udredning pågår. Specifik behandling beskrives i Afsnit 12.1.7.2:
Høj mortalitetsrisiko:
- behandles med samtidig opstart af trombolyse og ufraktioneret heparin (UFH, inkl. bolus). Som alternativ til UFH kan evt. anvendes LMH. Behandlingen bør opstartes hurtigst muligt, når diagnosen er stillet. Hvis der er givet LMH inden opstart af trombolyse, udskydes UFH-infusion i 12-24 timer
- høj-risiko patienter med kontraindikation mod eller manglende effekt af trombolyse bør konfereres med center mhp. overflytning og mulighed for kirurgisk embolektomi, kateterbaseret behandling og/eller mekanisk kredsløbsstøtte
Intermediær-høj mortalitetsrisiko:
- behandles med LMH eller UFH-infusion (inkl. bolus)
- der er ikke indikation for rutinemæssig trombolysebehandling, men patienten skal monitoreres tæt, og ved kliniske tegn på hæmodynamisk instabilitet intensiveres behandlingen svarende til behandling af patienter med høj mortalitetsrisiko
- tidligt i forløbet lægges en strategi for eventuel intensivering af behandlingen ved forværring af patientens tilstand
Intermediær-lav mortalitetsrisiko:
- behandles med direkte orale antikoagulantia (DOAK) eller LMH
Lav mortalitetsrisiko:
- behandles med DOAK eller LMH
- kan behandles ambulant
Tilfældigt fundet LE ved CT-angiografi:
- tilfældigt fund af LE i forbindelse med anden udredning hos patienter med malign sygdom behandles som udgangspunkt med antikoagulationsbehandling (AK-behandling) i minimum 6 måneder
- fund af samme hos patienter uden malign sygdom vurderes individuelt mhp. opstart af AK-behandling og varighed heraf. I vurderingen bør indgå overvejelser om tilstedeværelse af symptomer, risiko for recidiv og blødningsrisiko og trombebyrden. CT-angiografien bør (re-)vurderes af erfaren radiolog for at undgå over- eller fejldiagnosticering. Man kan overveje UL af underekstremiteter, idet fund af DVT giver indikation for AK-behandling. Såfremt man undlader opstart af behandling, bør patienten alligevel tilbydes ambulant opfølgning og evt. kontrol billeddiagnostik
12.1.7.2 Specifikke behandlinger
Trombolysebehandling
Der savnes håndfast evidens for valg af specifikke farmaka og doseringsregimer. Bedst evidens haves for:
- infusion alteplase 100 mg i.v. i løbet af 2 timer (typisk 10 mg bolus efterfulgt af 90 mg over 2 timer). Ved legemsvægt
- ved behov for hurtigere infusion (f.eks. hæmodynamisk kollaps/hjertestop) kan alternativt gives 50 mg bolus (eller 0,6 mg/kg, dog maksimalt 50 mg) i løbet af 15 minutter, resten infunderes over 2 timer
- alternativt kan andre trombolytika/doseringsregimer med hurtig infusion anvendes off-label. Ledsagende behandling med UFH er beskrevet nedenfor
Kontraindikationer mod trombolyse er bl.a.:
- intrakraniel blødning eller hæmoragisk apopleksi
- iskæmisk stroke
- intrakraniel eller intraspinal tumor
- intrakraniel kirurgi eller hovedtraume
- aktiv blødning bortset fra menstruation
- aortadissektion
- traume eller større kirurgisk indgreb med risiko for blødning
- gastrointestinal eller anden indre blødning
Øvrige: Der henvises til www.pro.medicin.dk
Ved livstruende LE er alle kontraindikationer relative. Ved manglende effekt af trombolyse skal der ikke gives trombolyse igen.
Behandling med UFH
Bør primært anvendes til høj-risiko patienter, som behandles med trombolyse eller embolektomi, eller ved klinisk mistanke om senere behov for trombolyse eller embolektomi. UFH bør ligeledes overvejes, såfremt patienten har nyreinsufficiens (GFR 165 kg) eller høj blødningsrisiko (bedre mulighed for reversering med protaminsulfat og behandlingsmonitorering med APTT).
Hvis der i forvejen er givet LMH, undlades UFH-infusion de første 12-24 timer.
UFH-behandling (også ved samtidig opstart af trombolyse):
- bolus på 80 IE/kg i.v. (max 10.000 IE)
- initial infusionshastighed: 14 IE/kg/time (max 2.250 IE/time)
- dosisjusteringer foretages i henhold til APTT-værdier, som tilstræbes forlænget 1,5-2,5 gange i forhold til udgangsværdien. APTT måles før opstart, 4-6 timer efter opstart og 6 timer efter hver dosisjustering. Når det anførte behandlingsniveau er opnået, måles 1 gang dagligt. Alternativt kan dosisjusteringer foretages i henhold til ACT-værdier, som tilstræbes forlænget til 160-180 sek
- efter 1-2 døgn kan UFH skiftes til terapeutisk LMH eller DOAK uden monitorering. Første LMH/DOAK-dosis gives, når UFH-infusionen afbrydes
Kirurgi og kateterbaseret behandling
Hos høj-risiko patienter bør muligheden for kirurgisk embolektomi eller kateterbaseret behandling (embolektomi eller lokal trombolyse) konfereres med invasivt center i tilfælde af kontraindikationer mod systemisk trombolyse eller ved insufficient effekt af trombolyse. Kateterbaseret behandling af patienter med intermediær-høj risiko kan overvejes i studiesammenhæng.
Langtidsbehandling
Efter trombolysebehandling, kirurgisk embolektomi eller kateterbaseret embolektomi/trombolyse behandles med LMH, indtil patienten er stabil og nærmer sig udskrivelse. Herefter opstartes langtidsbehandling i form af DOAK. Patienter i lav og intermediær-lav risiko kan påbegynde DOAK uden forudgående LMH (bortset fra dabigatran eller edoxaban der i modsætning til rivaroxaban og apixaban, skal forudgås af behandling med LMH i mindst 5 døgn). DOAK er lige så effektiv som VKA og har en lavere risiko for blødning, hvorfor DOAK er førstevalg i fravær af kontraindikationer.
DOAK doseres jf. Kapitel 14: Antikoagulationsbehandling Tabel 14.3
For behandling af cancerpatienter se Afsnit 12.4.
Til gravide og ammende, se Afsnit 12.5 og DSTHs retningslinje
Til patienter med antifosfolipidsyndrom (særligt triple-positive) anvendes VKA, alternativt LMH.
Recidiv af VTE trods pågående AK-behandling i terapeutisk dosering konfereres med tromboseklinik.
Indledning, monitorering og kontraindikationer ved VKA-behandling er omtalt i Kapitel 14: Antikoagulationsbehandling LMH doseres jf. Kapitel 14: Antikoagulationsbehandling Tabel 14.4.
12.1.8 Varighed af AK-behandling
Tentativ varighed af AK-behandlingen fastsættes ved udskrivelsen og revurderes ved planlagt ambulant besøg efter 3-6 mdr. Behandlingsvarigheden bør i tvivlstilfælde konfereres med tromboseklinik (se Kapitel 14: Antikoagulationsbehandling). Som udgangspunkt anbefales nedenstående:
- LE sekundært til en stærk temporær risikofaktor: 3 mdr
- LE uden stærk temporær risikofaktor: minimum 6 mdr. i terapeutisk dosering og evt. varig behandling, oftest i profylaksedosis (under hensyntagen til trombose- og blødningsrisikoen)
- LE sekundært til stærk permanent risikofaktor: som udgangspunkt varig behandling i terapeutisk dosering
- recidiv LE: minimum 6 mdr. i terapeutisk dosering og herefter som udgangspunkt varig behandling, evt. i profylaksedosis (under hensyntagen til trombose- og blødningsrisikoen)
Recidivrisikoen afhænger især af omstændighederne ved den primære LE. Tabel 12.4 giver eksempler på temporære og permanente risikofaktorer og kategoriserer dem i henhold til langtidsrisikoen for recidiv. Kortvarig AK-behandling anbefales, hvis recidivrisikoen skønnes lav (8% per år). Ofte vil recidivrisikoen imidlertid være intermediær (3-8% per år), hvorved beslutningen om at afbryde/fortsætte AK-behandlingen må bero på en grundig individuel vurdering af patientens samlede aktuelle risikoprofil, herunder blødningsrisikoen, samt patientens præferencer. Som oftest vil der være indikation for langvarig AK-behandling med profylaksedosis DOAK. Især ved udbredt/livstruende LE eller udbredt proksimal DVT bør patienter med intermediær recidivrisiko overvejes varigt AK-behandlet.
Patienter med udbredt/livstruende LE er kandidater til livslang AK-behandling, som også anbefales ved tilstedeværelse af visse former for trombofili (se retningslinje for trombofili på www.dsth.dk). Patienter med recidiv af uprovokeret LE eller DVT har som udgangspunkt indikation for permanent AK-behandling
Forhøjet alderskorrigeret D-dimer under og efter endt AK-behandling er en risikomarkør for recidiv af LE. Måling af D-dimer kan eventuelt anvendes som led i vurdering af recidivrisikoen, såfremt AK-behandlingen overvejes seponeret. Genoptagelse/fortsættelse af AK-behandlingen, evt. i profylaksedosis, bør overvejes ved forhøjet D-dimer.
Fornyet billeddiagnostik anbefales ikke rutinemæssigt ved planlagt ophør med AK-behandling.
Patienter med aktiv cancersygdom udgør en særlig problemstilling i relation til den sekundære tromboseprofylakse (se Afsnit 12.4).
12.1.9 Efterbehandling og kontrol
Patienter med LE bør som udgangspunkt henvises til ambulant opfølgning efter 3-6 mdr.
Hvis ekkokardiografi ved indlæggelsen viser tegn på forhøjet pulmonaltryk, kan undersøgelsen gentages før udskrivelsen, og hvis pulmonaltrykket fortsat er forhøjet (TI-gradient >40 mmHg), gentages ekkokardiografien efter 3-6 mdr. i relevant AK behandling mhp. identifikation af kronisk tromboembolisk pulmonal hypertension (CTEPH). Hvis ekkokardiografien ved opfølgning viser tegn til pulmonal hypertension (TI-gradient >40 mmHg) uden anden oplagt forklaring, bør patienten tilbydes billeddiagnostik af lunger mhp. udredning for CTEPH, initialt i form af ventilations-/perfussionsskintigrafi (Vedrørende CTEPH se Kapitel 13: Pulmonal hypertension). Hvis der i forbindelse med ambulant opfølgning efter LE er vedvarende symptomer (primært åndenød) skal fornyet ekkokardiografi foretages trods tidligere ekkokardiografi uden tegn til pulmonal hypertension. Ved symptomer uden anden oplagt årsag, bør ventilations-/perfussionsskintigrafi fortsat overvejes til trods for normal TI. Ved tegn til kronisk tromboembolisk sygdom eller tvivl konfereres med PH center.
Udredning for trombofili anbefales til selekterede patienter med VTE. Dette med henblik på vurdering af risiko for recidiv, indikation for langvarig AK-behandling samt type af AK-behandling. Det betyder, at yngre patienter (www.dsth.dk).
12.2 Dyb venetrombose
12.2.1 Definition
DVT er trombedannelse i de dybereliggende vener. Langt den hyppigste lokalisation er bækkenets og underekstremiteternes vener. Distal DVT er lokaliseret i crus-venerne (vv. tibiales, v. peronea og muskelvener), mens proksimal DVT er lokaliseret i v. poplitea og proksimalt herfor.
12.2.2 Forekomst
DVT er en relativ hyppig tilstand med en incidens på ca. 1 tilfælde /1.000 personer/år. Risikoen stiger fra ca. 1/10.000 personer/år for individer under 40 år til ca. 1/100 personer /år for individer over 80 år.
12.2.3 Ætiologi
DVT i bækkenets eller underekstremiteternes vener forekommer især hos patienter med underliggende tilstande, der disponerer til VTE: nylig operation, cancer, langvarig immobilisation, bækkenvenestenose/kompression og graviditet. DVT kan også ses hos tidligere raske personer, hvoraf nogle vil have uerkendt arvelig eller erhvervet trombofili.
12.2.4 Symptomer og kliniske fund
Symptomer og objektive fund
Det er afgørende at få den kliniske mistanke, da symptomer og fund kan være diffuse eller fraværende. Kliniske scoringssystemer (f.eks. Wells’ DVT score, se Tabel 12.5) kan derfor med fordel anvendes.
Parakliniske fund
D-dimer har en meget høj sensitivitet og negativ prædiktiv værdi. Hos hospitaliserede patienter med konkurrerende lidelser samt ældre og gravide er testen dog ofte forhøjet af anden årsag, og D-dimer kan derfor primært anvendes til at udelukke DVT. En ikke-forhøjet alderskorrigeret D-dimer kan ved lav klinisk sandsynlighed (Wells’ DVT score = 0) bruges til at udelukke diagnosen.
12.2.5. Udredning
Klinisk undersøgelse
Anvendes til at vurdere den kliniske sandsynlighed for DVT (Wells’ DVT score, Tabel 12.5).
Billeddiagnostiske undersøgelser
Ved Wells’ DVT score = 0 og ikke-forhøjet alderskorrigeret D-dimer er der ikke indikation for billeddiagnostiske undersøgelser. Undersøgelse bør overvejes i alle andre tilfælde.
Ultralydsscanning af underekstremiteter
Ved ultralydsscanning med kompression og flowundersøgelse kan DVT påvises med høj diagnostisk sensitivitet og specificitet hos patienter med proksimal DVT, mens undersøgelsen udført under knæniveau har lavere diagnostisk præcision. Undersøgelsen anbefales altid udført fra lyske til ankelniveau. Billeddokumentation er obligat og essentiel for vurderingen af progression/recidiv ved symptomudvikling. Ved forhøjet D-dimer og klinisk mistanke om DVT (Wells’ DVT score ≥1), men fravær af DVT ved ultralydsscanning, gentages ultralydsundersøgelsen efter ca. 8 dage, idet tilfælde, som progredierer proksimalt, herved vil kunne diagnosticeres. CT flebografi kan overvejes ved diagnostisk usikkerhed.
12.2.6 Prognose
Ubehandlet har patienten høj risiko for udvikling af posttrombotisk syndrom og evt. LE. Hurtig diagnostik og behandling er derfor vigtig.
12.2.7 Behandling
AK-behandling
AK-behandlingens formål er at hindre:
- progression af den venøse trombe
- embolisering af tromben
- recidiv af VTE
- senkomplikationer i form af posttrombotisk syndrom
Behandling af proksimal DVT følger samme retningslinjer som for lav-risiko LE, hvorfor der henvises til Afsnit 12.1.7. Isoleret distal DVT behandles som udgangspunkt kortvarigt (3-6 mdr.).
Trombolysebehandling
Systemisk trombolyse anbefales ikke. Anvendelse af katetervejledt lokal trombolyse til patienter med massive ileofemorale venetromboser bør overvejes, idet behandlingen formentlig nedsætter risikoen for posttrombotisk syndrom i forhold til AK-behandling alene. Behandlingen foretages kun på få centre i Danmark (Sygehus Lillebælt Kolding og Rigshospitalet) og skal opstartes senest 14 dage efter diagnose. Diagnosen bekræftes med CT af abdomen med kontrast i venøs fase. Kontraindikationerne for behandling er de samme som for systemetisk trombolyse, hvor venøs trombektomi evt. kan tilbydes ved svære symptomer.
Kompressionsstrømper
Effekten af kompressionsstrømper til knæniveau er omdiskuteret i forhold til risiko for udvikling af posttrombotisk syndrom. Strømper med et ankeltryk på 30-40 mmHg kan anvendes ved symptomatisk DVT. Kompressionsstrømper tages af om natten. Anbefalet behandlingsvarighed er som udgangspunkt 6 mdr. hos symptomatiske patienter, og kan forlænges ved fortsatte symptomer på venøs insufficiens.
12.2.8 Varighed af AK-behandling
Ved førstegangs distal DVT behandles i 3-6 mdr. Herudover gælder samme overvejelser og anbefalinger som ved LE, hvorfor der henvises til Afsnit 12.1.8.
12.2.9 Efterbehandling og kontrol
Der planlægges opfølgende kontrol med henblik på stillingtagen til behandlingsvarighed efter 3-6 måneder, hvis dette ikke kan afgøres på diagnosetidspunktet. Vedrørende trombofiliudredning gælder samme forhold som beskrevet under LE (Afsnit 12.1.9).
12.3 Atypiske venetromboser
12.3.1 Superficiel venøs trombose
Behandlingen af superficiel venøs trombose (tidligere kaldet superficiel tromboflebitis) i underekstremiteten afhænger af lokalisation og udbredelse:
- superficiel venøs trombose over knæniveau behandles med rivaroxaban 10 mg x 1 (alternativt enten fondaparinux 2,5 mg s.c. x 1 eller dalteparin 150 IE/kg/dag) i 6 uger, hvis ultralydsscanning viser trombe >5 cm lang, og/eller hvis trombens proksimale afgrænsning er
- hvis der samtidig påvises DVT, gives AK-behandling som ved DVT i mindst 3 mdr. (se Afsnit 12.1.8)
- øvrige superficielle venøse tromboser, inklusive på overekstremiteten, behandles som udgangspunkt blot med smertestillende medicin samt evt. hirudoid-creme og kompressionsstrømpe, men lavdosis DOAK kan efter klinisk skøn evt. tillægges i få uger
- der er ikke indikation for trombofiliudredning efter superficiel venøs trombose
12.3.2 Overekstremitets DVT
Overekstremitets DVT (OE DVT) præsenterer sig klinisk som underekstremitets DVT (UE DVT) med hævelse, ømhed, øget venetegning og evt. misfarvning. Som ved UE DVT stilles diagnosen ved kompressions UL. D-dimer er ofte falsk negativ og deraf af begrænset diagnostisk værdi.
OE DVT er oftest provokerede og okkult malignitet skal altid overvejes som mulig udløsende faktor. Intravenøse katetre eller infusion af karirriterende medikamenter er hyppige årsager til OE DVT. Hos yngre med recidiverende OE DVT skal venøst thoracic outlet syndrome (afklemning af v.subclavia mellem costa 1 og clavicula) overvejes. Underliggende trombofili er sjældent, hvorfor trombofiliudredning ikke anbefales rutinemæssigt.
Der gives AK-behandling i doser som ved VTE. Behandlingsvarigheden er som udgangspunkt 3-6 mdr., men afhænger af de specifikke omstændigheder.
Post-trombotisk syndrom er relativt hyppigt efter OE DVT. Behandling med armkompressionsstrømpe kan forsøges.
12.3.3 Splanknisk venetrombose
Splankniske venetromboser inkluderer tromboser i portalvenerne, mesenterielle tromboser samt Budd Chiari syndrom (trombose i vv. hepaticae). Splankniske tromboser er oftest relateret til leversygdom, herunder cirrose, og intraabdominal sygdom. Såfremt ingen af disse er tilstede kan der undersøges for JAK2-mutationen, som udtryk for underliggende myeloproliferativ sygdom.
I fravær af svær leverpåvirkning (dvs. Child Pugh B og C) kan DOAK anvendes i doser som ved DVT. Behandlingsvarigheden er som udgangspunkt 6 mdr.
For nærmere information henvises til retningslinjen ”Splanknisk trombose, diagnostik og behandling” udgående fra Dansk Selskab for Gastroenterologi og Hepatologi.
12.4 Venøs tromboembolisk sygdom hos cancerpatienter
Patienter med aktiv cancersygdom udgør en særlig problemstilling i relation til den sekundære tromboseprofylakse.
Cancerpatienter har en ca. 4 gange øget risiko for VTE recidiv og en fordoblet risiko for blødning sammenlignet med patienter uden cancer. Særlige problemer hos cancerpatienten er øget komorbiditet, påvirkning af nyre- og leverfunktion, farmakologiske interaktioner, varierende lægemiddeloptagelse (pga. kvalme, opkastning, diarré) trombocytopeni og ofte behov for pausering i forbindelse med invasive indgreb.
Behandling af cancer-associeret trombose
For nærmere detaljer henvises til rapporten Cancer og Venøs Tromboembolisme (www.dsth.dk). DOAK (apixaban, edoxaban eller rivaroxaban) anbefales som førstevalg ved cancer-associeret trombose. Dette under hensyntagen til interaktioner, nyrefunktion og cancertype (herunder metastasering på kritiske lokalisationer, f.eks. CNS) hvor LMH kan overvejes. I så fald anvendes dalteparin eller tinzaparin, begge doseret x 1 dgl.
Dosering (for patienter med normal nyrefunktion):
- Tinzaparin: 175 IE/kg s.c. x 1
- Dalteparin: 200 IE/kg s.c. x 1 med reduktion til 150 IE/kg x 1 efter 1 md
I sjældne tilfælde (f.eks. hos patienter med mekaniske klapper) kan man overveje VKA under nøje monitorering af INR.
Hvis DOAK vælges, skal man udelukke kendte interaktioner mellem den onkologiske behandling og det valgte DOAK (se f.eks. www.cat-app.dk). Der bør udvises skærpet opmærksomhed på blødningsrisikoen hos patienter med specifikke former for cancer. Hos patienter med luminal gastrointestinal cancer og urogenital cancer er der dokumenteret forhøjet blødningsrisiko under behandling med rivaroxaban og edoxaban sammenlignet med LMH, som derfor anbefales. Alternativt kan anvendes apixaban, som synes at have en blødningsprofil sammenlignelig med LMH hos disse patienter.
Patienter med cancer og tilfældigt fundet asymptomatisk VTE skal som udgangspunkt AK-behandles efter samme anbefalinger som ved symptomatisk VTE.
Behandlingsvarigheden vurderes individuelt, f.eks. i regi af Tromboseklinik. Som udgangspunkt fortsættes behandling, så længe der er aktiv cancer. Der skal foretages en individuel vurdering af varigheden efter komplet remission af cancersygdommen, dvs. risikoen for cancerrecidiv, før evt. seponering af AK-behandlingen. Patientens grundsygdom kan progrediere til et stadie, hvor fortsat AK-behandling ikke længere er meningsfuld.
Såvel DOAK som LMH kan udleveres vederlagsfrit til patienter med cancer-associeret trombose.
12.5 Venøs tromboembolisk sygdom hos gravide
Graviditet medfører øget risiko for VTE som følge af hyperkoagulabilitet og øget tryk på de dybe bækkenvener med kulmination omkring fødselstidspunktet og i det tidlige puerperium. I den vestlige verden er LE den hyppigste årsag til død blandt gravide.
D-dimer kan anvendes som hos ikke-gravide, altså kan en normal værdi udelukke VTE, hvis der ikke er høj klinisk mistanke.
Ved graviditet skal der tages hensyn til strålepåvirkning af især den gravides brystvæv (stråledosis ved CT-angiografi 3-10 mGy), mens fostret kun modtager en mindre stråledosis (stråledosis ved CT-angiografi 0,05-0,5 mGy). Behovet for akut udredning må dog ikke negligeres, og vanlig diagnostik anbefales til den akut påvirkede gravide. Således foretages akut CT-angiografi ved hæmodynamisk og/eller svær respiratorisk påvirkning. Ventilations-/perfussionsskintigrafi foretrækkes til udredning af patienter, som ikke er akut påvirkede. Påvisning af DVT med ultralydsscanning er uden strålebelastning og kan alternativt anvendes som basis for LE diagnose og behandling. Som ved alle andre røntgenbaserede billeddiagnostiske undersøgelser af gravide skal der udvises forsigtighed med CT, særligt i 6.-14. graviditetsuge.
Ekkokardiografi er obligat Kapitel 31: Graviditet og hjertesygdom.
Behandling
AK-behandling under graviditet er en specialistopgave, som varetages i samarbejde mellem obstetrikere og trombokardiologer. Behandling af LE under graviditet baseres på vægtjusteret (prægravid vægt) LMH, der i modsætning til VKA og DOAK ikke passerer placenta (se også Kapitel 31: Graviditet og hjertesygdom).
LMH eller VKA kan anvendes efter graviditeten. LMH og warfarin (men ikke phenprocoumon) kan anvendes under amning. DOAK er kontraindiceret til gravide og ammende.
Erfaringen med trombolysebehandling af LE hos gravide og post partum er begrænset. Blødningsrisikoen er ca. 8%, primært vaginalt. Hvis den gravide opfylder indikationen for trombolyse, må behandlingsstrategien overvejes i fælleskonference mellem obstetrikere, neonatologer, thoraxkirurger, kardiologer og patienten hvis muligt.
Vedr. AK-behandling af gravide og ammende henvises til retningslinjen ”Graviditetsrelateret trombose – risikovurdering, udredning, profylakse og behandling” og applikationen ”Risikovurdering og anbefaling af tromboseprofylakse til gravide”, begge tilgængelige via www.dsth.dk. I denne vejledning omtales behandlingsvarighed, profylakse og forholdsregler ved fødsel/sectio.