35. Farmaka og kardiovaskulære komplikationer
35.1 NSAID og hjertesygdom
Morten Schmidt, Bo Christensen
35.1.1 Baggrund
NSAID hæmmer enzymet cyclooxygenase (COX), som har to isoenzymer (COX-1 og COX-2). NSAID anvendes for dets smertestillende og anti-inflammatoriske egenskaber. Potentielle bivirkninger ved NSAID inkluderer gastrointestinal blødning og ulcus, men også kardiovaskulær sygdom.
35.1.2 NSAID og risiko ved specifik hjertekarsygdom
Iskæmisk hjertesygdom
- brug af nyere selektive COX-2 hæmmere (coxibs), diclofenac og højdosis ibuprofen (>1200 mg/dag) er forbundet med øget risiko for myokardieinfarkt
- den absolutte risiko for myokardieinfarkt er proportional med behandlingslængden. Den absolutte risiko er højest for patienter med kendt kardiovaskulær sygdom, men også forhøjet hos raske individer med øget risiko for kardiovaskulær sygdom eller påvist non-obstruktiv koronar sygdom ved hjerte-CT
- den relative risiko for myokardieinfarkt øges umiddelbart efter opstart af NSAID behandling. Der er således ikke holdepunkter for antagelser om risiko-frie behandlingsperioder
- den øgede risiko ved brug af diclofenac er på højde med coxibs og højere end andre ældre COX-2 hæmmere (etodolac og meloxicam) og nonselektive NSAID (ibuprofen og naproxen). Der er øget risiko ved brug af både høj og lav dosis diclofenac
Hjerteinsufficiens
- brug af NSAID kan medføre væskeretention, forværring af perifere ødemer og lungestase
- brug af NSAID fordobler den relative risiko for udvikling af hjerteinsufficiens og øger risikoen for genindlæggelser for hjerteinsufficiens
- brug af NSAID er associeret til iskæmiske komplikationer hos hjertesvigtspatienter
Hypertension
- NSAID øger hos raske risikoen for udvikling af behandlingskrævende arteriel hypertension med op til 50% og forårsager en gennemsnitlig stigning i det systoliske blodtryk på 2-4 mmHg.
- NSAID kan medføre et fald i GFR på op til 25% og derved risiko for udvikling af nyreinsufficiens, særligt ved samtidig brug af diuretika og ACE-hæmmere/AT2-antagonister (såkaldt ”tripple whammy”).
- NSAID øger risikoen for destabilisering af blodtryksregulering grundet kompromitteret effekt af diuretika og ACE-hæmmere/AT2-antagonister.
Atrieflimren
- brug af NSAID er associeret til øget risiko for atrieflimren
- risikoen er størst lige efter opstart af behandlingen og ved brug af COX-2 selektive NSAID
Venøs tromboembolisme
- brug af NSAID er associeret til øget risiko for dyb venetrombose og lungeemboli
- samtidig brug af NSAID og hormonale kontraceptiva er associeret til en betydelig øget risiko for venøs tromboembolisme hos yngre kvinder
Blødning
- samtidig brug af NSAID og antitrombotika (både pladehæmmere og antikoagulantia) øger blødningsrisikoen hos patienter med iskæmisk hjertesygdom, atrieflimren og venøs tromboembolisme.
Livsstil
- livsstils risikofaktorer og lav socioøkonomisk status er forbundet med øget NSAID brug
- den forhøjede relative risiko for kardiovaskulære events ved NSAID brug hos raske personer ses både hos personer med og uden tilstedeværelsen af individuelle risikofaktorer (undersøgt for BMI, rygning, alkoholoverforbrug, diabetes, inaktiv livsstil, forhøjet kolesterol, og lav socioøkonomisk status)
35.1.3 Behandling
- NSAID anbefales som en del af behandlingen af akut perikarditis, men frarådes ellers generelt til hjertepatienter eller raske personer i øget risiko for kardiovaskulær sygdom.
- NSAID til hjertepatienter udskrives overvejende i almen praksis (90%). Andelen af hjertepatienter der udskrives NSAID til inden for et år efter diagnosetidspunktet er stadig højt (14%).
- alternativer til NSAID behandling bør tage udgangspunkt i den enkelte patient og dennes øvrige sygdomstilstande og kan indeholde non-farmakologiske tiltag (f.eks. træning, afspænding, tværfaglig rehabilitering, sygdomsmestring, gode søvnvaner og fordeling af aktiviteter hen over hele dagen) og/eller andre analgetika som f.eks. paracetamol.
- påkrævet anvendelse af NSAID i behandlingen af komorbide tilstande hos patienter med kendt hjertekarsygdom bør kun finde sted ved særlige indikationer, hvor der ikke er andre alternativer og efter grundig overvejelse af risiko og gavn af behandlingen. Samråd på tværs af specialer (reumatologi, kardiologi og smerteklinikker) kan ofte være nødvendigt. Der henvises til DCS’ holdningspapir for NSAID behandling hos patienter med hjertekarsygdom.
Til behandling af kroniske smerter henvises desuden til den trinvise tilgang i Sundhedsstyrelsens Smerteguide (https://www.sst.dk/da/Udgivelser/2019/Smerteguide) Her hovedpunkter:
- paracetamol er 1. valg. Effekt ved langtidsbehandling (>6 uger) er ikke belyst
- analgetikum til neuropatiske smerter anvendes ved neuropatisk komponent
- ved kroniske, nociceptive smerter er balancen mellem effekt og bivirkninger ved langtidsbehandling med opioid uhensigtsmæssig for de fleste patienter. Langtidsbrug øger risikoen for bl.a. afhængighed, aftagende effekt og opioidinduceret hyperalgesi. Opioider kan være indiceret hos få patienter med svære invaliderende smerter. Gennemsnitligt opnår kun ca. 10 % en klinisk relevant effekt i løbet af 3-6 måneder ift. placebo. Her vælges døgndækkende behandling med depotpræparat. Optrapning kan med fordel foregå alene med depotpræparat. Seponér opioid, hvis klinisk relevant effekt ikke nås inden for de første 1-2 måneder
35.2 CT røntgenkontrast og kardiovaskulære komplikationer
35.2.1 Baggrund
Jodholdige kontraststoffer består af trijod benzen derivater og inddeles på baggrund af kemisk struktur i non-ioniske dimerer ellers non-ioniske monomerer. Alle kontraststoffer anvendes intravaskulært til fremstilling og visualisering af anatomiske strukturer. Kontraststofferne udskilles uomdannet gennem nyrerne.
Der er ikke krydsallergi mellem iodholdige fødevarer, iodholdige farmaka og iodholdige røntgenkontrastmidler
35.2.2. Bivirkninger
Bivirkningerne ses hos ≤3% af patienterne i form af opkastning, kløe, sved, varmefølelse, udslæt, ansigtsødem, larynxødem, lungeødem, kramper, nyrepåvirkning, respirationsstop og hjertestop. Behandlingskrævende reaktioner ses hos ca. 0,04%, mens letale reaktioner forekommer yderst sjældent, ca. ved 1:1.000.000 undersøgelser. De allergilignende bivirkninger er dosisuafhængige, hvilket ikke gør sig gældende ved de ikke-allergilignende reaktioner, f.eks. ved kontrastinduceret akut nyreinsufficiens.
Størstedelen af behandlingskrævende reaktioner sker inden for de første 20 minutter. Senreaktioner (bivirkninger), startende mere end 1 time efter kontraststofinjektionen, kan være feber, kulderystelser, udslæt, kløe, ledsmerter, diarre, kvalme, hovedpine og i enkelte tilfælde hypotension, som sjældent er behandlingskrævende. Senreaktioner, fraset nyrepåvirkning, er dosis uafhængige. Størstedelen af de sene hudreaktioner ses efter en latenstid på 3 timer til 2 dage efter kontraststofundersøgelsen og forsvinder oftest efter 1-7 dage.
35.2.3 Kontraststofs allergi
Præsentation
- urtikaria
- bronkospasme
- lungeødem
- angioødem
- hypotension/shock
Profylakse
Overordnet er hjertesyge patienter samt patienter med astma/allergi, kendt tidligere kontrastreaktion og nyresygdom i øget risiko for kontrast allergi.
Hos patienter med risiko for udvikling af kontraststofsreaktion kan præmedicinering (paraplydække) f.eks. gennemføres således:
- aftenen inden proceduren:
- tablet Prednisolon 30 mg
- hvis patienten ikke kan tage tabletter gives inj. hydrocortison (Solu-Cortef) 100 mg i.v. eller inj. methylprednisolon (Solu-medrol) 40-80 mg i.v.
- på proceduredagen (morgen)
- Hydrocortison (Solu-Cortef) 100 mg i.v. eller inj. methylprednisolon (Solu-medrol) 40-80 mg i.v.
- Clemastin (Tavegyl) 2 mg i.v.
- ved uopsættelig undersøgelse (akut KAG, subakut hjerte CT mv.) kan paraplydække gennemføres så snart undersøgelsen er besluttet og senest når patienten er på lejet med
- Hydrocortison (Solu-Cortef) 100 mg i.v. eller inj. methylprednisolon (Solu-medrol) 40-80 mg i.v.
- Clemastin (Tavegyl) 2 mg i.v.
Behandling
Urticaria: Antihistamin, f.eks. clemastin 2 mg iv.
Bronkospasme: Ilt på maske, Beta2 inhalation, antihistamin, f.eks. clemastin 1-2 mg i.v, adrenalin 0,5mg i.m., hydrocortison 400 mg i.v. (eller 80 mg methylprednisolon i.v.)
- let bronkospasme: Beta2 inhalation
- moderat bronkospasme: Adrenalin 0,5 mg i.m. Kan gentages efter 15 min ved manglende effekt
Svær bronkospasme/angioødem/larynxødem: Tilkald anæstesi. Luftveje sikres, ilt på maske evt. intubation eller tracheostomi, antihistamin, f.eks clemastin 2 mg i.v., adrenalin.
- lettere tilfælde: Adrenalin 0,5 mg i.m. Kan gentages efter 15 min ved manglende effekt
- moderate/svære tilfælde: Adrenalin 0.05 mg i.v. i refrakte doser (1 ml adrenalin iblandes 20 ml isotonisk NaCl – der gives 1 ml opblanding per dosis) gentages til effekt under BT- og EKG-monitorering, derefter infusion 0,001-0,005 mg/min
Hypotension/shock: Adrenalin 0,05 mg i.v. i refrakte doser (1 ml adrenalin iblandes 20 ml isotonisk NaCl – der gives 1 ml opblanding per dosis) gentages hvert minut til blodtryksmål er nået, derefter infusion 0,001-0,005 mg/min, isotonisk NaCl (0,9%) 1-3 l i første time, ilt på maske, hydrocortison 200 mg i.v. (eller methylprednisolon 80 mg iv), og antihistamin f.eks. clemastin 2 mg i.v.
35.2.4 Kontrastinduceret akut nyreinsufficiens (CI-AKI)
CI-AKI udvikles med større sandsynlighed hos patienter med eksisterende nyrefunktionsnedsættelse. Toksiciteten af kontrast øges ved dehydrering, akut nyreinsufficiens og ved stigende kontrastforbrug. Det er derfor særligt vigtigt at undgå dehydrering før kontrasteksponering hos patienter med kendt nedsat nyrefunktion eller ved mistanke om dette.
CI-AKI defineres som en stigning i plasma kreatinin > 26.5 umol/l indenfor 48 timer af kontrasteksponering eller 1.5 x baseline inden for 7 dage af kontrasteksponering. Nyrepåvirkningen når sit maksimum efter 2-3 døgn og er som hovedregel reversibel indenfor 7-10 dage.
Risikoen for CI-AKI er betinget af en række patient- og procedurerelaterede faktorer, herunder særligt avanceret kronisk nyresygdom (eGFR < 30ml/min/m2).
Profylakse mod CI-AKI
Præprocedure
- vurder nyrefunktionen ved eGFR (CKD-EPI formlen er bedst valideret). Ved forudgående akut nyrefunktionspåvirkning anvendes p-kreatinin, da eGFR er udtryk for steady-state og dermed forbundet med diagnostisk latens
- pauser al ikke-nødvendig nefrotoksisk medicin
- sørg for at patienten er euvolæm
Peri- og postproceduralt
- begræns mængden af kontrast mest muligt
- sørg for tilstrækkeligt indtag af peroral væske
- anvendelse af diuretika ved akut nyresvigt forbeholdes patienter med manifest overhydrering
- indlagte patienter bør have kontrolleret væsketal dagen efter samt 3-5 dage postproceduralt
Ved eGFR <30 ml/min/1.73m2, hjertesvigt, leversvigt, diabetes med senkomplikationer, eller tidligere CI-AKI kan behandlingen individualiseres.
Nyreinsufficiens bør ikke afholde gennemførsel af nødvendige kontrastundersøgelser.
35.2.5 Behandling af patienter med kendt nyreinsufficiens
Forberedelse
- undgå NSAID, gentamycin, nylig start eller optitrering af ACE/ATII hæmmere, diuretika eller anden nefrotoksisk behandling
- tilstræb interval >72 timer mellem kontrastudsættelse
- begræns mængden af kontrast mest muligt
Der er ikke evidens for anvendelse af præprocedure væsketerapi.
Behandling af patienter med terminal eller dialysekrævende nyreinsufficiens kan fordre særlige forholdsregler, idet kontrastbehandling til patienter med begrænset restdiurese er forbundet med øget risiko for manifest kronisk dialysebehov.
Der er ikke evidens for anvendelse af postprocedural dialyse mhp. øget kontrastudskillelse efter CT-kontrasteksponering blandt patienter med kronisk nyreinsufficiens.
35.2.6 Metformin
- kan fortsættes ved normal nyrefunktion hos stabile patienter
- ved nedsat nyrefunktion (eGFR <45 ml/min/1.73m2 eller tilsvarende forhøjet p-kreatinin) anbefales det at pausere metformin 48 timer før invasiv undersøgelse om muligt. Metformin kan genoptages 48 timer efter proceduren, såfremt nyrefunktionen ikke er forringet
- ved indikation for akut invasiv undersøgelse hos diabetespatienter med nedsat nyrefunktion skal fordele versus risici overvejes. Metformin pauseres, passende hydrering af patient sikres og nyrefunktionen følges tæt efterfølgende
- ved stigende p-kreatinin postproceduralt pauseres metformin, ACE/ATII hæmmere, NSAID og anden nefrotoksisk behandling til p-kreatinin er i vanligt niveau. Pausering af diuretika bør gennemføres ved tegn til volumedepletering
35.3 Psykofarmaka og kardiovaskulær sikkerhed
Jakob Hartvig Thomsen, Henning Bundgaard, Steen Pehrson
35.3.1 Psykofarmaka og hjertet
Flere psykofarmaka kan udløse alvorlig ventrikulær arytmi (proarytmi), som i værste fald kan være dødelig. Opmærksomheden har i særlig grad været rettet mod farmaka, som forlænger hjertemuskelcellernes repolarisering og derved øger det elektrokardiografiske QT interval, som associeres med optræden af torsade de pointes ventrikulær takykardi (TdP-VT). TdP-VT kan degenerere til ventrikelflimren.
35.3.2 Risikofaktorer
En række faktorer øger risikoen for lægemiddelinduceret TdP-VT:
- alder ≥65 år
- hjertesygdom: Hjertesvigt, tidligere myokardieinfarkt samt præeksisterende forlænget QT-interval (QTc >480 ms)
- familieanamnese med visse typer arytmisygdom
- hjertesymptomer (synkoper, palpitationer, dyspnø eller brystsmerter)
- bradykardi
- elektrolytforstyrrelser, specielt for lavt plasma-kalium <3,5mol/l
- behandling med to eller flere QT forlængende lægemidler, herunder også somatiske lægemidler
- nedsat levermetabolisme (pga. nedsat leverfunktion eller lægemiddelinteraktion)
- høj dosis og anvendelse af lægemidler med interaktion, der øger koncentrationen af QT forlængende lægemidler
- anoreksia nervosa
35.3.3 Algoritme mhp. reduktion af risiko for hjertearytmi og pludselig død
Algoritmen (Figur 35.1) er vejledende ved vurderingen af den kardiale risiko i forbindelse med farmakologisk behandling af psykiatriske tilstande.
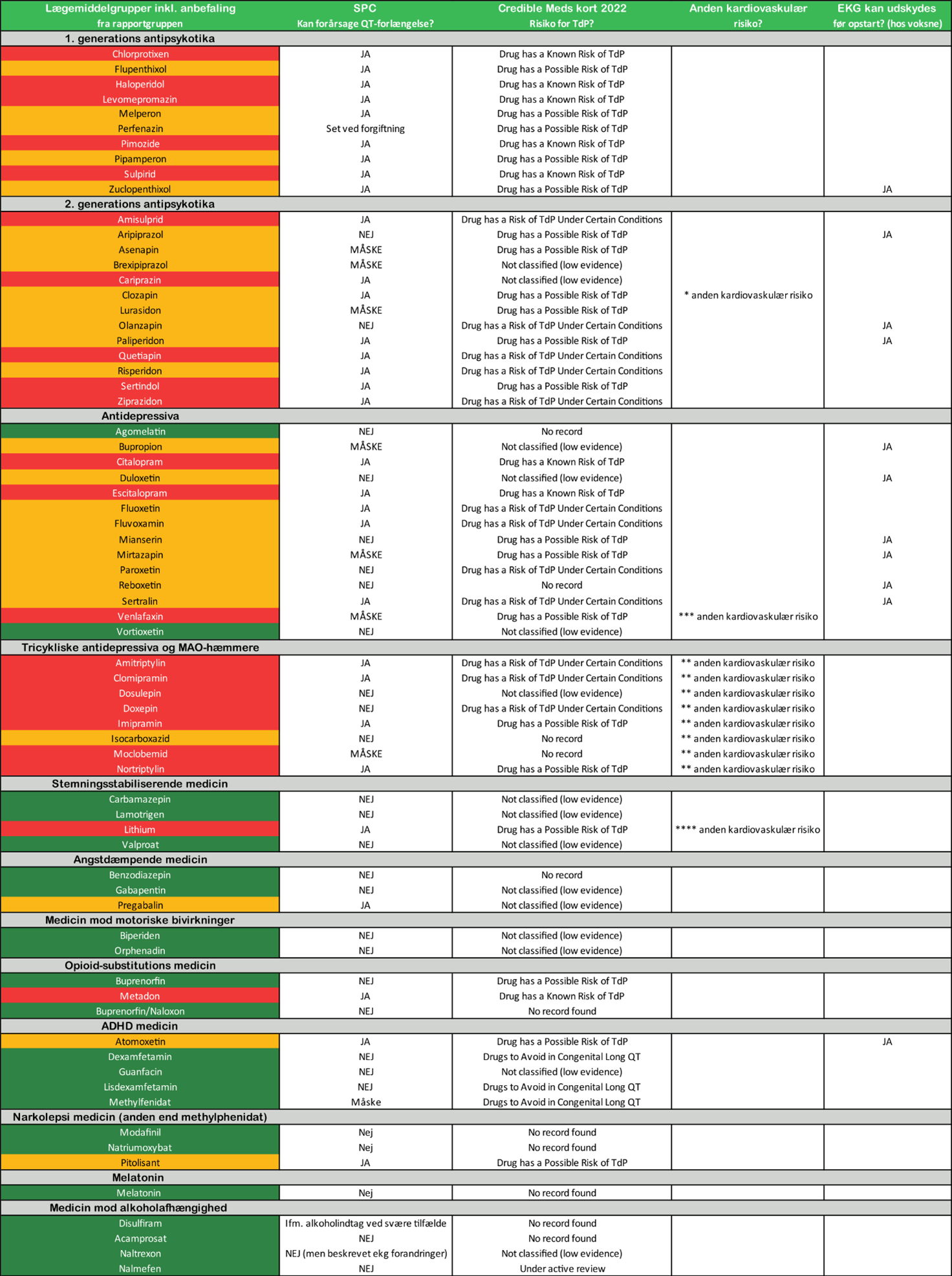
Psykofarmaka inddeles jvf Tabel 35.1 i ”grønne præparater” uden risiko for QTc forlængelse, ”gule præparater” med risiko for let QTc forlængelse, evt. kun under visse omstændigheder; og ”røde præparater” med risiko for øget QTc forlængelse og dokumenteret risiko for arytmi. Algoritmen er tilpasset med en differentieret tilgang til indledning af behandling, hvor det ved gule og røde præparater som udgangspunkt anbefales, at der foretages en risikovurdering, herunder, at der foretages EKG-vurdering før behandlingsstart. Ved indledning af behandling med røde præparater bør der foreligge en vurdering af den kardiologiske risikoprofil. Ved enkelte gule præparater kan EKG udskydes før opstart.
Algoritmen er ikke baseret på et entydigt videnskabeligt grundlag, men overvejende på konsensus. For at gøre algoritmen brugbar i klinisk sammenhæng, har det været nødvendigt at anføre specifikke krav/grænser. Disse skal anvendes ud fra en samlet klinisk vurdering, herunder behandlingsbehovet.
Med den nuværende viden er det ikke muligt at beregne en risikoscore, som kvantitativt udtrykker risikoen for lægemiddelinduceret proarytmi. Det bedste praktiske råd er derfor at være særlig opmærksom på øget risiko udtrykt ved risikofaktorerne (jf. punkt 35.3.2), jo flere risikofaktorer, der foreligger, desto højere proarytmisk risiko. Endvidere skal man være opmærksom på, at lægemiddelinteraktioner vil kunne øge risikoen for arytmi
Ved mistænkt eller påvist hjertesygdom anbefales det, at behandlingen af patienten foregår i samarbejde med kardiolog.
Akut antipsykotisk behandling
Ved behov for akut antipsykotisk behandling af hjertesyge patienter, anbefales det at vælge et grønt eller gult præparat. Ved behandling med røde præparater må monitorering under indlæggelsen overvejes, hvilket også kan være indiceret af psykiatriske grunde. En sådan monitorering omfatter
- udspørgen om arytmisuspekte symptomer (palpitationer, nærsynkoper og synkoper)
- elektrokardiografisk telemetri og/eller hyppige EKG-optagelser
Behandling bør generelt foregå under observation iht. algoritmens »Hjertekontrol« (Figur 35.1). Ved utilstrækkelig behandlingseffekt bør anden farmakologisk monoterapi tilstræbes før kombinationsbehandling iværksættes, idet samtidig behandling med to eller flere gule og røde præparater antages at øge risikoen for arytmi betydeligt. Hvis kombinationsbehandling er nødvendig bør »Hjertekontrol« følges – uanset om patienten har hjertesygdom eller ej.
Hvis udgangs-EKG viser QTc >480 ms (uden grenblok, dvs QRS <~120 ms) anbefales drøftelse med kardiolog, såfremt behandling med QT forlængende præparat overvejes. Hvis der observeres QTc >500 ms eller en øgning af QTc på >60 ms i forhold til det initiale EKG, bør seponering overvejes. Ved hjertefrekvens ≤80 slag i minuttet anbefales ved EKG aflæsningen Bazett’s korrektion (QTc = QT/RR1/2) og ved >80 slag i minuttet anbefales Fridericia’s korrektion (QTc = QT/RR1/3).
Nye hjertesymptomer, specielt arytmisuspekt synkope, eller øgning af QTc til >500 ms eller med mere end ca. 15% (60 ms), må opfattes som kardiale risikomarkører. Seponering eller evt. dosisreduktion skal overvejes og alternativ behandling med et ”grønt” præparat bør overvejes på ny. Fortsat behandling bør kun finde sted, hvis patienten kardialt set er asymptomatisk og på tvingende indikation – og efter drøftelse mellem psykiater og kardiolog. Hvis man fortsætter behandlingen, bør det være under skærpet kontrol. Det er i denne sammenhæng afgørende, at kardiologen får adgang til alle relevante EKG’er og ikke kun et enkelt, samt oplyses om den kliniske problemstilling, somatisk sygdom og den medicinske behandling.
Hvis der under psykofarmakabehandling opstår QTc >550 ms (uden samtidigt grenblok), med eller uden symptomer, bør der straks tages kontakt til kardiolog mhp. eventuelt behov for telemetri. Ved så abnorme værdier af QTc vil der oftest være iøjnefaldende abnorme T-takker i form af to-puklethed, med udtalte U-takker med større amplitude end T-takkerne, eller flade langstrakte T-takker.
Ved anvendelse af gule og røde præparater bør patienterne informeres om, at nye hjertesymptomer, særlig hjertebanken, nærbesvimelser eller besvimelser, bør føre til umiddelbar lægekontakt.
En lang række andre lægemidler kan påvirke ventriklernes repolarisering og forlænge QT-intervallet. Der henvises til hjemmesiden www.crediblemeds.org for en komplet liste. Indenfor kardiologiske lægemidler drejer det sig særligt om klasse III antiarytmika (dronedarone, sotalol og amiodaron), flekainid i sjældne tilfælde samt lægemidler, der kan forårsage hypokaliæmi (tiaziddiuretika, loopdiuretika).
35.3.4 Anbefalinger ift. psykofarmakologisk behandling af patienter med kongenit Lang QT Syndrom (LQTS)
Patienter med kongenit LQTS inkluderer en mindre gruppe patienter, hvor særlig agtpågivenhed er anbefalet i forhold til psykofarmakologisk behandling. Evidensniveauet er generelt meget sparsomt, om end enkelte præparater som udgangspunkt kan anvendes.
Eksempler på præparater, der kan anvendes ved kongenit LQTS, er antidepressiva som agomelatin og vortioxitin, som ikke medfører QT forlængelse samt antiepileptika som Carbamazepin, Lamotrigen og Valproat. Angstdæmpende medicin som benzodiazepiner og gabapentin samt medicin mod motorisk uro som biperiden og orphenadin kan anvendes. Ved behandling af narkolepsi kan modafinil og natriumoxybat anvendes, og melatonin kan anvendes mod søvnløshed. Dertil kan præparater mod alkoholafhængighed anvendes (disulfram, acamprosat, naltrexon, nalmefen).
Der anbefales som udgangspunkt at fremsøge præparatet på www.crediblemeds.org ift. opdateret anbefaling før opstart af behandling. En specifik liste med "Drugs to be avoided by Congenital Long QT patients” kan findes efter registrering af gratis brugerkonto på hovedsiden.
Ved uopsættelig behandlingsindikation uden mulighed for brug af anbefalede præparater, bør der konfereres med kardiolog ift. valg af præparat og evt. behov for monitorering under opstart.
35.3.5 Særlige forhold ved behandling af børn og unge
Selvom danske børn og unge generelt har et godt somatisk helbred, anbefales det som udgangspunkt at man ud fra et forsigtighedsprincip vurderer kardielle risikofaktorer og vurderer et baseline EKG på alle børn under 18 år, der startes i behandling med lægemidler med proarytmisk risiko, dvs. præparater markeret som gule og røde i Tabel 35.1. I øvrigt følges algoritmen (Figur 35.1).
Figur 35.1: Algoritme til anvendelse ifm. behandling med psykofarmaka for at reducere risikoen for at udvikle hjertearytmi og pludselig død |
 |
*Patienter med grenblok (venstre (LBBB) som højresidigt (RBBB) eller ventrikulært pacet rytme og forlænget QT interval anbefales konfereret med kardiolog. En metode til vurdering af QTc intervallet hos denne gruppe er QT (målt i ms) fratrukket 50% af QRS bredden i ms og efterfølgende vanlig korrektion for hjertefrekvens. Der henvises til rapporten ”Arytmi-risiko ved anvendelse af psykofarmaka” vedr. anbefalinger ift. personer med kongenit langt QT syndrom samt børn og unge. |
35.4 Cabergolin og hjerteklapsygdom
Vibeke Guldbrand Rasmussen, Caroline Michaela Kistorp
35.4.1 Definition
Den ergotamin-deriverede dopamin-agonist cabergolin kan medføre fibrose på hjerteklapperne og derved give anledning til klapinsufficiens.
Cabergolin bruges i begrænset omfang i behandlingen af Parkinsons sygdom, på grund af de fibrotiske bivirkninger.
I mindre doser anvendes cabergolin til restless legs syndrom samt ved hyperprolaktinæmi (Dostinex).
35.4.2 Udredning
Ved cabergolin behandling og opstart heraf:
- overveje henvisning til ekkokardiografi før iværksættelse af behandlingen
- ved højdosis (≥2 mg/uge) anbefales ekkokardiografi hvert andet år
- ved lavdosis behandling (< 2 mg/uge) kan ekkokardiografisk kontrol bestemmes individuelt, men bør gennemføres mindst hvert 5. år. Patienterne bør vurderes klinisk årligt i behandlingsansvarlige afdeling og henvises til ekkokardiografi ved ny mislyd.
35.4.3 Prognose
Ved påvist klapforandringer er der grund til at antage, at fortsat cabergolin behandling vil forværre klappåvirkning. Der er utilstrækkelig viden om, hvorvidt seponering af cabergolin medfører regression af klapforandringerne.
35.4.4 Behandling
Seponering af cabergolin bør ske ved
- påvist moderat, klinisk betydende klapsygdom på de venstresidige klapper* og/eller
- moderat til svær pulmonal hypertension
*Progression fra let til moderat tricuspidal insufficiens giver ikke i sig selv indikation for seponering af cabergolin, men kræver en grundig vurdering af tricuspidalklappens morfologi og mobilitet samt udelukkelse af sekundær påvirkning af tricuspidalklappen
Ved let insufficiens af de venstresidige hjerteklapper og/eller let pulmonal hypertension må videre behandling bero på en individuel vurdering.
Ved påvist klapsygdom følges patienten jf. Kapitel 6: Hjerteklapsygdom.
35.5 Interaktioner og kardiovaskulære komplikationer
Anders Nissen Bonde, Maja Hellfritzsch Poulsen
35.5.1 Baggrund
Lægemiddelinteraktioner opstår, når et lægemiddel ved sin tilstedeværelse i kroppen ændrer effekten af et andet. Lægemidler kan også interagere med fødemidler og naturlægemidler. De fleste lægemiddelinteraktioner har ingen klinisk relevans, mens nogle kan have negative konsekvenser for patienten i form af toxicitet eller suboptimal effekt. Visse lægemiddelinteraktioner er ønskede og dermed en del af den klinisk farmakologiske behandling, fx ved hypertension.
Dette kapitel gennemgår de vigtigste og/eller hyppigste interaktioner med kardiologiske lægemidler. Målet er at skabe overblik for læger i den daglige behandling af den kardiologiske patient. Det fulde omfang af lægemiddelinteraktioner kan ikke dækkes her, hvorfor vi opfordrer til brug af fx www.interaktionsdatabasen.dk (overvejende farmakokinetiske interaktioner baseret på publicerede studier samt data fra produktresumeer fra nye lægemidler og også data på hyppigt anvendte naturlægemidler), www.webmd.com/interaction-checker/ og http://www.drugs.com/drug_interactions.html.
Klinisk betydende interaktioner ses oftest ved brug af lægemidler med snævert terapeutisk interval (eks. VKA-behandling, samt visse psykofarmaka, antiepileptika og antiarytmika).
Man skelner mellem farmakodynamiske interaktioner, hvor lægemidlernes virkning på organismen (effekt/bivirkninger) påvirkes, og de farmakokinetiske interaktioner, hvor lægemidlernes kinetik (absorption, distribution, metabolisering og udskillelse) påvirkes.
P-glykoprotein (P-gp) er et transportprotein med betydning for absorption og ekskretion af lægemidler. CYP-enzymerne (fx CYP3A4) er vigtige for metaboliseringen af mange lægemidler forud for udskillelse gennem nyrerne eller med galden.
35.5.2 DOAK
DOAK har flere metaboliseringsveje og er derfor i mindre grad påvirkelige af farmakokinetiske interaktioner end VKA. Alle DOAKs er substrater til P-gp. Apixaban og rivaroxaban er herudover også substrater til CYP3A4. Tabel 35.2 viser kendte og potentielle farmakokinetiske interaktioner med DOAK.
Farvekoderne repræsenterer anbefalinger fra overvejelse om reduceret dosis til regulær kontraindikation, som angivet nederst i tabellen.
Vedr. potentielt blødningsfarlige farmakodynamiske interaktioner med andre lægemidler, herunder antitrombotika henvises til Kapitel 14: Peroral antikoagulansbehandling. For interaktion mellem DOAK og antineoplastiske lægemidler henvises til www.cat-app.dk.
35.5.3 Warfarin
Warfarin metaboliseres af CYP2C9 (primært) og CYP3A4. Lægemidler, der påvirker (inducerer eller inhiberer) CYP2C9, giver således oftest anledning til betydende farmakokinetiske interaktioner med warfarin.
Generelt bør man ved ordination af et nyt lægemiddel hos patienter i warfarinbehandling undersøge det nye lægemiddels effekt på metaboliseringen af warfarin. Dette med særligt fokus på påvirkningen af CYP2C9 eller additive effekter. Ved tvivl bør INR måles 3-6 dage efter opstart af ny medicin.
Nedenstående tabel indeholder information om de vigtigste præparater relateret til interaktion med warfarin:
35.5.4 Statiner
Statiner opdeles i stoffer, der metaboliseres via CYP3A4 (atorvastatin, lovastatin og simvastatin), og stoffer, der metaboliseres via andre veje (pravastatin [% CYP], fluvastatin [CYP2C9 (og CYP2C8)], og rosuvastatin [CYP2C9]).
For at undgå bivirkninger kan man enten:
- skifte til et statin, der ikke metaboliseres af CYP3A4 (pravastatin, fluvastatin, og rosuvastatin)
- dosisreducere statinpræparatet eller
- seponere relevant interaktionsmedicin
Lægemiddel | Enzym | Statin | Bivirkning | Anbefalinger |
|---|---|---|---|---|
Amiodaron | Inhiberer CYP2C9, CYP3A4, P-gp | Lovastatin | Øger statin koncentration/risiko for myopati | Reducer lovastatin dosis til 40mg dagligt |
Simvastatin | Reducer simvastatin dosis til 20mg dagligt | |||
Amlodipin | Inhiberer CYP3A4 | Lovastatin | Øger statin koncentration/ risikoen for myopati | Reducer lovastatin og simvastatin dosis til 20mg dagligt |
Simvastatin | ||||
Atazanavir, lopinavir/ritonavir | Inhiberer CYP3A4, CYP2D6 | Atorvastatin | Øger risiko for myopati | Ved bivirkninger reducer til acceptabel dosis |
Fluvastatin | Ved bivirkninger reducer til acceptabel dosis | |||
Lovastatin | Undgå kombination med lovastatin | |||
Rosuvastatin | Ved bivirkninger reducer til acceptabel dosis | |||
Simvastatin | Undgå kombination med simvastatin | |||
Ciclosporin | Inhiberer CYP3A4, P-gp | Atorvastatin | Øger statin koncentrationen gennem adskillelige mekanismer Øger risikoen for myopati | Reducer atorvastatin dosis til 10 mg dagligt |
Fluvastatin | Reducer fluvastatin dosis til 40 mg dagligt | |||
Lovastatin | Undgå kombination | |||
Rosuvastatin | Reducer rosustatin dosis til 5 mg dagligt | |||
Simvastatin | Undgå kombination | |||
Digoxin | - | Atorvastatin | Øger digoxin koncentrationen | Vær opmærksom på digoxin bivirkninger |
Diltiazem | Inhiberer CYP3A4, P-gp | Atorvastatin | Øger statin koncentrationen/ risikoen for myopati | Ikke nødvendigt at justere atorvastatin |
Lovastatin | Reducer lovastatin dosis til 20 mg dagligt | |||
Simvastatin | Reducer simvastatin dosis til 10 mg dagligt | |||
Dronedaron | P-gp | Lovastatin | Øger statin koncentrationen/ risikoen for myopati | Reducer lovastatin og simvastatin dosis til 10 mg dagligt |
Simvastatin | ||||
Fibrater bortset fra gemfibrozil (kontraindiceret) | Inhiberer CYP2C9 | Atorvastatin | Risiko for myopati, rhabdomyolyse, akut nyresvigt | Reducer statindosis betydeligt (f.eks. højest anbefalede simvastatin dosis 10 mg). |
Fluvastatin | ||||
Lovastatin | ||||
Rosuvastatin | ||||
Simvastatin | ||||
Fluconazol For øvrige ”azoler” (Itraconazol, ketoconazol, voriconazol og posaconazol) se Tabel 35.6 | Inhiberer CYP2C9, CYP3A4 | Atorvastatin | Myopati | Ved bivirkninger reducer til acceptabel dosis |
Fluvastatin | ||||
Lovastatin | ||||
Rosuvastatin | ||||
Simvastatin | ||||
Fusidin | Inhiberer CYP3A4 | Atorvastatin | Myopati, rhabdomyolyse | Statiner bør pauseres ved behandling med fusidin og først genoptages 7 dage efter ophør med fusidin |
Fluvastatin | ||||
Lovastatin | ||||
Rosuvastatin | ||||
Simvastatin | ||||
Gemfibrozil | Inhiberer OATP1B1 | Atorvastatin | Øger statin koncentrationen/ risikoen for myopati | Kan kombineres |
Lovastatin | Undgå kombination | |||
Rosuvastatin | Kan kombineres | |||
Simvastatin | Undgå kombination | |||
Fluvastatin | Undgå kombination | |||
Ticagrelor | Inhiberer CYP3A4 | Atorvastatin | Øger statin koncentrationen/ risikoen for myopati | Ingen ændring |
Lovastatin | Ingen ændring | |||
Simvastatin | Ingen ændring | |||
Verapamil | Inhiberer CYP3A4, P-gp | Lovastatin | Øger statin koncentrationen/ risikoen for myopati | Reducer lovastatin dosis til 20 mg dagligt |
Simvastatin | Reducer simvastatin dosis til 10 mg | |||
Warfarin | CYP2C9 | Atorvastatin | Umiddelbart ingen ændring | Kan kombineres |
Fluvastatin | Højere INR/risiko for blødning | Tættere opfølgning af INR initielt | ||
Lovastatin | ||||
Rosuvastatin | ||||
Simvastatin | ||||
Forkortelser: CYP, cytochrome P; OATP, organic anion-transporting polyprotein; P-gp, permeability glycoprotein; INR, international normalised ratio. Rød, kontraindiceret/ikke anbefalet. Orange, overvej reduceret dosis. | ||||
35.5.5 Anti-infektiøs medicin
Tillæg af visse typer anti-infektiøs medicin kan give anledning til betydende interaktioner med patientens kardiologiske behandling. Det drejer sig hovedsageligt om gruppen af makrolider og azol-svampemidler samt HIV-lægemidler.
I kardiologisk sammenhæng kan både makrolider og flourokinoloner (særligt moxifloxacin) desuden medføre QT-forlængelse.
Penicilliner og carbapenemer medfører sjældent interaktioner.
De systemiske svampemidler nystatin, anidulafungin og caspofungin har ingen betydende interaktioner med de typiske kardiologiske lægemidler.
Nedenstående tabeller er en oversigt over de vigtigste interaktioner samt behandlingsanbefalinger mellem kardiologiske lægemidler og makrolider samt ”azoler”.
| Azithromycin | Clarithromycin | Erythromycin | Roxithromycin |
|---|---|---|---|---|
Baggrund for interaktioner | Mulig P-gp hæmmer og påvirkning af bakterieflora i tarm. | Svag til moderat P-gp hæmmer og stærk CYP3A4 hæmmer. Påvirkning af bakterieflora i tarm. | Moderat hæmmer af CYP3A4 og P-gp. Påvirkning af bakterieflora i tarm. | Svag hæmmer af CYP3A4. Påvirkning af bakterieflora i tarm. |
Digoxin Substrat for P-gp. | Øget plasmakoncentration af digoxin. Evt. måling af S-digoxin samt monitorering af bivirkninger. | |||
Warfarin Substrat for bl.a. CYP3A4 og effekt påvirkelig af tarmflora. | Øget effekt af warfarin. Hyppig INR-kontrol | |||
Dabigatran, rivaroxaban, apixaban Hæmmer P-gp og CYP3A4. | Øget absorption og koncentration af dabigatran, rivaroxaban og apixaban. | |||
Edoxaban Hæmmer P-gp og CYP3A4. | Mangler data | Mangler evidens | Øget absorption og koncentration. Monitorer for blødning | Mangler data |
Statiner Simvastatin, atorvastatin og lovastatin er substrater for CYP3A4. | Øger moderat risikoen for rhabdomyolyse ved simvastatin, formentlig i mindre grad for lovastatin og atorvastatin. Risikoen for pravastatin og rosuvastatin er ikke beskrevet, men kan ikke udelukkes. Pauser statin eller monitorer bivirkninger | Kombination med simvastatin og lovastatin frarådes. Kombinationsbehandling med pravastatin og clarithromycin kan medføre øget plasmaoncentration af pravastatin. | Næppe klinisk betydende interaktion med statiner. | |
Antiarytmika Amiodaron, ronedarone, sotalol, flecainid | Øget risiko for QT-forlængelse. Kombination frarådes. | |||
Calciumantagonister. Verapamil og diltiazem hæmmer CYP3A4. Amlodipin og felodipin er substrater for CYP3A4. | Ingen data. | Verapamil og diltiazem øger plasmakoncentrationen af clarithromycin og erythromycin og øger risikoen for QT-forlængelse. Amlodipins og felodipins plasmakoncentration øges ved samtidig behandling med risiko for blodtryksfald. Kombination med verapamil og diltiazem frarådes. Monitorer blodtryk og overvej dosisjustering af felodipin og amlodipin. |
| |
Ticagrelor Substrat for CYP3A4 | Ingen data. | Øget plasmakoncentration af ticagrelor. Kombination frarådes. | Ingen data | |
Ivabradin Substrat for CYP3A4 | Ingen data. | Øget plasmakoncentration for ivabradin og risiko for QT-forlængelse. Kombination frarådes. | ||
Sildenafil Substrat for CYP3A4 | Ingen data. | Øget plasmakoncentration og dermed øget risiko for blodtryksfald. Kombination frarådes. | Ingen data | |
Forkortelser: CYP, cytochrome; P-gp, permeability glycoprotein. Rød, kontraindiceret/ikke anbefalet. Orange, overvej reduceret dosis. Gul, overvej reduceret dosis ved øvrige ”gule farmaka” eller øvrige risikofaktorer (f.eks. nedsat nyrefunktion, lav kropsvægt, ældre patienter). | ||||
Tabel 35.6: Lægemiddelinteraktioner med svampemidler (”azoler”) | ||||
| Fluconazol | Voriconazol | Itraconazol, Ketoconazol, Posaconazol | Miconazol |
|---|---|---|---|---|
Baggrund for interaktioner | Hæmmer CYP2C9 og i moderat grad CYP3A4 men dosisafhængigt | Hæmmer af CYP3A4 og CYP2C9 | Markant hæmmer af CYP3A4 og P-glucoprotein | Hæmmer CYP3A4 også ved oral gel |
Warfarin Substrat for bl.a. CYP3A4 og effekt påvirkelig af tarmflora. | Dosisafhængig øget eksponering af warfarin. Kontrol af INR og mulig dosisreduktion af warfarin. | |||
Dabigatran, Rivaroxaban, Apixaban | Moderat øget plasmakoncentration af rivaroxaban, få data for øvrige DOAK Observer bivirkninger. | Øget plasmakoncentration af rivaroxaban og apixaban. Kombination frarådes. Dog for dabigatran og prosaconazol, ikke kontraindiceret, overvej reduceret dosis (”orange interaktion”). | Teoretisk øget eksponering af rivaroxaban og apixaban. Observer for bivirkninger. | |
| Øget plasmakoncentration af edoxaban. Kombination frarådes. Man kan forsøge at reducere til 30 mg x 1. | |||
Statiner Simvastatin, atorvastatin og lovastatin er substrater for CYP3A4. Fluvastatin er substrat for CYP2C9. | Se Tabel 35.4 | Kan øge plasmakoncentration af simvastatin, lovastatin, atorvastatin og fluvastatin. Samtidig behandling frarådes. Pauser statin eller skift til pravastatin eller rosuvastatin. Hvis behandling med statin fortsættes da i lav dosis og under tæt monitorering af bivirkninger. | Kan øge plasmakoncentration af simvastatin, lovastatin og atorvastatin. Samtidig behandling frarådes. Pauser statin eller skift til pravastatin eller rosuvastatin. | Kan øge plasmakoncentration af simvastatin og fluvastatin. Pauser statin eller skift til pravastatin eller rosuvastatin. Hvis behandling med statin fortsættes da i lav dosis og under tæt monitorering af bivirkninger. |
Calciumantagonister Verapamil og diltiazem er substrater for CYP3A4. Amlodipin og felodipin er substrater for CYP3A4. | Øget plasmakoncentration af amlodipin, felodipin, lercanidipin. Monitorer bivirkninger. | Ingen data, ingen forventet interaktion | ||
AT-II antagonister | Øget plasmakoncentration af losartan og irbesartan. Næppe klinisk betydning. | Øget plasmakoncentration af losartan. Kontroller BT. | Ingen data | |
Ticagrelor Substrat for CYP3A4. | Øget plasmakoncentration af ticagrelor. Kombination frarådes. | Ingen data | ||
Ivabradin Substrat for CYP3A4. | Øget plasmakoncentration af ivabradin. Kombination frarådes. | Ingen data | ||
Digoxin Substrat for P-gp. | Ingen data | Øget plasmakoncentration af digoxin. Evt. måling af S-digoxin samt monitorering af bivirkninger. | Ingen data | |
Rød, kontraindiceret/ikke anbefalet. Orange, overvej reduceret dosis. Gul, overvej reduceret dosis ved øvrige ”gule farmaka” eller øvrige risikofaktorer (f.eks. nedsat nyrefunktion, lav kropsvægt, ældre patienter). | ||||